C. David/赵玉沛院士/吴文铭揭示「癌王发迹史」,为早期诊断与治疗提供潜在的靶点和思路
胰腺癌,因其难以早期发现且高致死率,被称为「癌症之王」。在许多组织中,致癌基因在组织干细胞中的激活,往往导致其癌变。但是相对于其它类型的组织来说,正常的胰腺细胞却很难被突变的 Kras 致癌基因所转化,即使超过 90% 的人类胰腺癌携带 Kras 基因突变 [1,2]。
Kras 致癌基因除了在胰腺癌的发展早期非常重要,在胰腺癌阶段,甚至是转移的过程中都起到了非常重要的作用。研究发现,Kras 基因能够调控胰腺癌中大量的代谢通路和对胰腺癌的生存,增值所必须的信号通路 [5]。鉴于 Kras 基因在胰腺癌的发展各个阶段都非常重要,那么 Kras 调控的转录网络是否在胰腺癌的早期就已经出现了呢?
那么在胰腺癌的发展早期,Kras 致癌基因是如何与胰腺炎联系,来共同促进胰腺癌的发生与发展的呢,这一联系目前还没有得到充分的研究。
2020 年 11 月 2 日,清华大学 Charles David 组,北京协和医院赵玉沛院士、吴文铭组合作在 Nature Cancer 发表了题为 Mutant Kras co-opts a proto-oncogenic enhancer network in inflammation-induced metaplastic progenitor cells to initiate pancreatic cancer 的研究论文 [6],在该项研究中,作者首次系统地阐述了胰腺癌前体细胞的转录组与表观遗传组信息,并阐明了 Kras 突变基因通过协同调控胰腺炎诱导的转录网络,来促进胰腺癌的产生与发展。为胰腺癌早期的诊断与治疗,提供了潜在的靶点和思路。

背景知识
研究表明,胰腺导管癌的产生往往伴随着严重的胰腺炎的出现,且由于 Kras 致癌基因的激活,与抑癌基因 Cdkn2a,Trp53, 和 Smad4 的缺失,携带胰腺炎的小鼠更容易发展成胰腺癌 [3]。
目前的研究发现,通过雨蛙素(一种肠促胰酶肽类似物)可以诱导小鼠产生急性胰腺炎,伴随着胰腺炎的产生,正常的胰腺腺泡细胞转化成导管形状的细胞,这种转化被称为 acinar-to-ductal metaplasia (ADM)。在没有 Kras 基因突变的情况下,停止雨蛙素注射两周左右,胰腺的形态会恢复成正常的样子。但是如果小鼠携带 Kras 突变,胰腺中会出现大量的 pancreatic intraepithelial neoplasia (PanIN),一种普遍认为的胰腺癌前体细胞 [4]。
研究内容
Klf5 表达的 ADM 细胞是胰腺癌前体细胞
为研究 Kras 突变基因对胰腺癌的发展早期转录组与表观遗传组的影响,作者找到了 Klf5 转录因子作为一种标志物,来进行胰腺癌早期细胞的分选。之前的研究表明,Klf5 作为人类胰腺癌中高表达的转录因子之一,在正常的胰腺导管细胞与 ADM 中出现,进而广泛地表达在 panIN 与胰腺癌细胞中 [7]。所以作者假设,可能 Klf5 表达的 ADM 细胞是胰腺癌的前体细胞。
如何验证 Klf5 表达的 ADM 细胞是胰腺癌前体细胞呢?
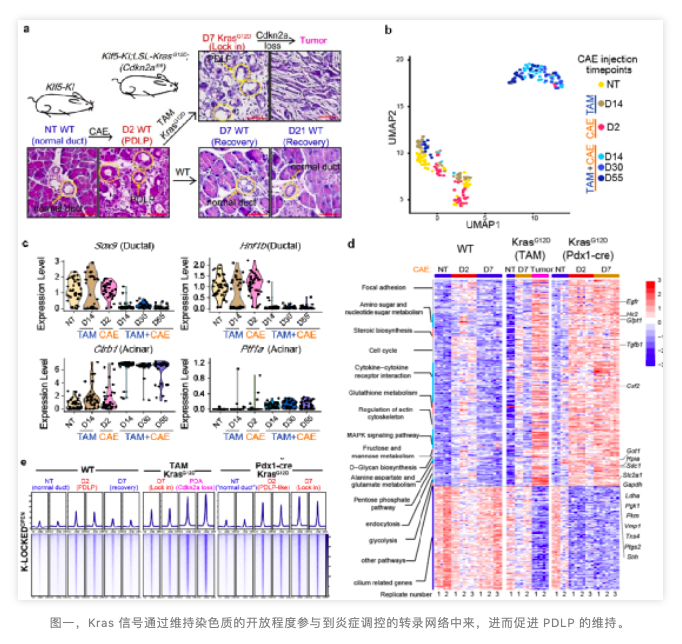
作者构建了 Klf5-mCherry-CreERT2; LSL-YFP 小鼠模型,不同时间点的单细胞转录组数据表明,同正常的导管细胞比较(NT,D14),Klf5 表达的 ADM 细胞随着炎症的消失,转变成了腺泡细胞,而表达 Klf5 的正常导管细胞却几乎没有改变(图一 b,c)。这些数据表明,Klf5 表达的 ADM 细胞具有分化的能力。
作者构建了 Klf5-mCherry-CreERT2;LSL-KrasG12D; LSL-Cdkn2afl/fl 小鼠模型,通过雨蛙素的注射,诱导 Klf5 表达的 ADM 细胞的产生。通过 tamoxifen(TAM)激活这群细胞中的 Cre 酶来诱导 KrasG12D 基因的转录与 Cdkn2a 肿瘤抑制基因的缺失,确定 Klf5 表达的 ADM 细胞最终能够发展成胰腺癌 (图一,a)。作者将这群被胰腺炎诱导产生,进而被 Kras 突变基因所维持,具备发展成胰腺癌的能力的 ADM 细胞称之为 pancreatic duct-like progenitor cells (PDLP cells)。
为比较 PDLP 细胞与正常的胰腺导管细胞在转录组上的区别,利用雨蛙素诱导 Klf5-mCherry-CreERT2 小鼠产生 PDLP 细胞群,通过少量细胞 RNA-seq 技术,将它与正常的胰腺导管细胞进行比较。发现对胰腺癌的发展非常重要的代谢通路、增值信号与其它信号通路在 PDLP 细胞群中就已经出现。
如果小鼠不携带 Kras 突变,大约在注射雨蛙素七天之后,胰腺接近恢复正常,这些信号通路也会随之下调。但当小鼠携带 Kras 基因突变,停止注射雨蛙素,PDLP 细胞也会被维持,进而向 panIN 方向发展,这些在 PDLP 中上调的信号通路也被维持(图一,d)。
通过分析 Peng et al. 2020 的人类胰腺癌单细胞 RNA-seq 数据,作者发现在大量在 PDLP 中上调的基因于人类胰腺癌也是高表达的。这些实验数据表明, Kras 突变能够维持胰腺炎诱导产生的信号通路,来促进人类胰腺癌的发生发展。
为探究 Kras 突变基因是如何调控 PDLP 中转录组的,作者利用相同的小鼠模型与药物处理方式,分选出 PDLP 细胞,来研究 PDLP 的染色质开放程度。与正常的胰腺导管细胞进行比较发现,PDLP 中大量高激活基因的附近,其染色质也变得更加开放。这种开放的染色质区域也会随着炎症的消失而下调,但是会被 Kras 突变基因所维持与增强(图一,e)。通过与 H3K27ac,H3K4me ChIP-seq 数据进行比较发现,这些被 Kras 突变体所维持的染色质开放区域更多地富集在基因组的 enhancer 区域。
Kras 调控的转录网络促进癌症的发生发展
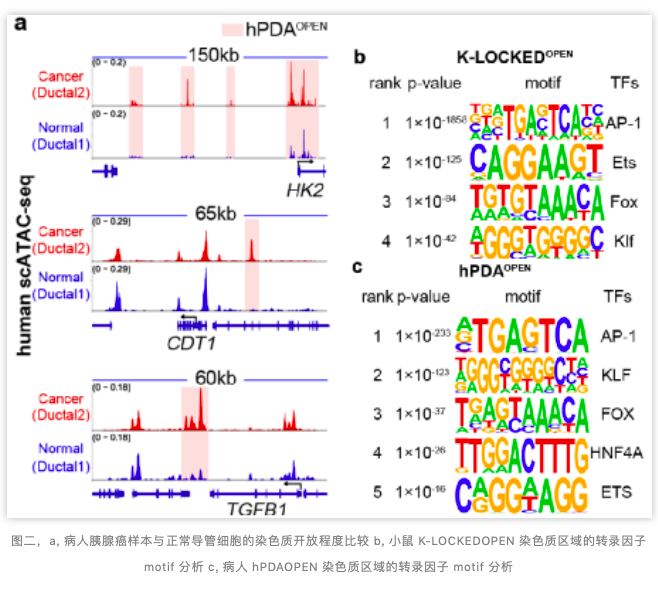
Kras 作为上游的信号因子,调控非常多的信号通路来促进基因的转录。作者进行了转录因子的 motif search,发现 AP1,Ets,Fox,Klf 转录因子家族的 motif 在此区域进行了富集(图二,b)。这暗示了这些转录因子家族可能参与到 Kras 调控的 PDLP 转录调控网络中来。
吴文铭组彭俊雅博士将病人胰腺癌样本与导管细胞进行了单细胞 ATAC-seq 测序,在 PDAC 中发现了与 PDLP 中类似的开放区域(图二,a、c)。这暗示了在 PDLP 中开放的区域,在病人 PDAC 是保守开放的。
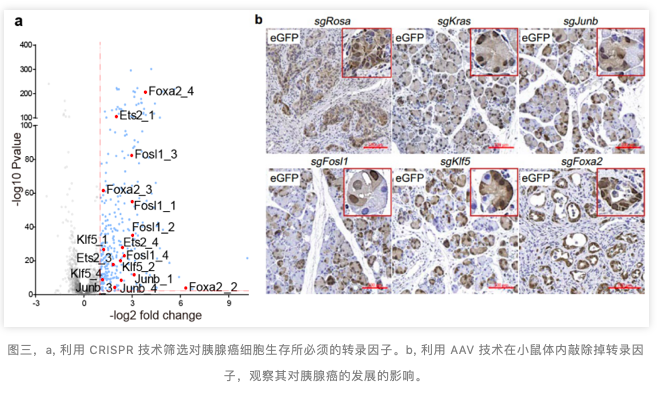
考虑到 Kras 突变基因对癌细胞生存的重要性,作者在小鼠癌细胞系中利用 CRISPR 技术,进行了在人类胰腺癌中高表达的转录因子的筛选。研究发现,敲除掉 AP1 家族中的 Fosl1,Junb,Klf 家族中的 Klf5 与 Fox 家族中的 Foxa2,都对胰腺癌的生存产生了阻碍(图三,a)。
为了探究 Junb,Fosl1,Klf5 与 Foxa2 在胰腺癌的发展早期的作用,作者利用腺相关病毒血清型(携带 Cdkn2a, Trp53, 和 Smad4 这三个在胰腺癌中高突变的肿瘤抑制基因的 sgRNA 与目标转录因子的 sgRNA)去分别敲除掉这几个转录因子。跟对照组的 PDAC 相比,敲除掉 Junb,Fosl1 和 Klf5 后,小鼠胰腺大部分处于正常形态(图三,b)。且其 Kras 调控的转录组与表观遗传组与对照组比较,也极大地被下调。这些数据表明了,在胰腺癌的发展的早期,Junb,Fosl1 与 Klf5 参与到 Kras 调控的转录网络中来,促进癌症的发生发展。
Kras 对胰腺癌的发生发展的分子机制
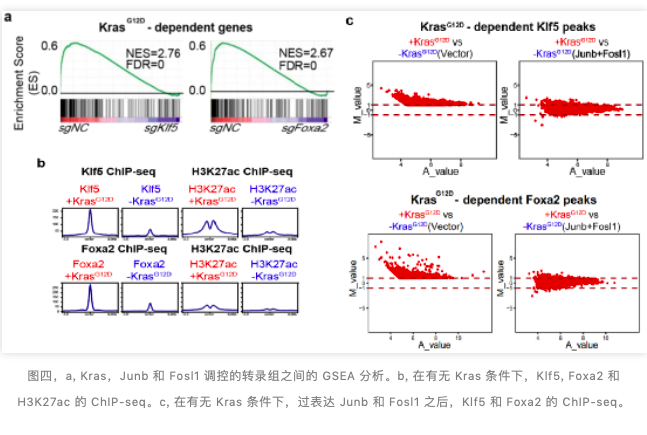
作者利用染色质富集蛋白组学 (ChEP)、WB 发现,Junb 与 Fosl1 蛋白稳定性直接受 KrasG12D 的调控。但是 Klf5 与 Foxa2 的转录,翻译,核定位都不直接受 KrasG12D 的调控。但是通过 RNA-seq 分析,作者发现,Klf5,Foxa2 与 KrasG12D 调控相似的基因网络(图四,a)。
利用 Tet-on KrasG12D 胰腺癌细胞系,作者进行了 Klf5 的 ChIP-seq,发现在有 Kras 的条件下,Klf5 与 Foxa2 更倾向结合到 Kras 调控的 PDLP 激活基因的 enhancer 区域,而在没有 Kras 的情况下,Klf5 与 Foxa2 倾向结合到一些在胰腺导管细胞高分化基因的上游。这些数据表明了,Klf5 与 Foxa2 与 Kras 之间的联系,可能是通过在染色体上的再分布来实现的(图四,b)。
致癌基因下游的转录因子可以通过招募细胞内已有转录因子的再定位,来促进致癌通路的激活。作者将 Kras 调控 Klf5 结合的染色质区域进行 motif search,发现了 AP1 转录因子家族 motif 的富集,提示 AP1 家族转录因子可能是 Klf5 受 Kras 的影响,在染色体上的重新定位的因素。作者利用 Tet-on KrasG12D 胰腺癌细胞系,在没有 Kras 突变基因的情况下,过表达 Junb 和 Fosl1 蛋白。与没有过表达的对照组相比较,Klf5 被重新定位到受 Kras 调控的 enhancer 的区域(图四,c)。
这些数据表明了,Kras 对胰腺癌的发生发展的分子机制,是通过促进其下游的 Junb,Fosl1 转录因子,使 Klf5 与 Foxa2(在正常的胰腺细胞里面高表达的转录因子)结合到促癌基因的 enhancer 区域来,进而促进下游基因的转录来实现的。
在这项研究中,作者发现一群在 ADM 中表达 Klf5 的 PDLP 细胞,经过证明它们是一群高表达了促癌转录调控网络的胰腺癌前体细胞。而这种转录调控网络是 Kras 通过促进 Junb 与 Fosl1 在激活的 enhancer 区域结合,进而招募 Klf5 与 Foxa2 在此区域的结合,进而协同控制的。
在该项研究中,作者首次系统地阐述了胰腺癌前体细胞的转录组与表观遗传组信息,并阐明了 Kras 突变基因通过协同调控胰腺炎诱导的转录网络,来促进胰腺癌的产生与发展。为胰腺癌早期的诊断与治疗,提供了潜在的靶点和思路。
清华大学医学院 Charles David 组博士生李勇,博士生贺毅,以及北京协和医院医学科学研究中心彭俊雅博士为本文共同第一作者。