Nature:非酒精性脂肪性肝炎限制抗肿瘤免疫监视
肝细胞肝癌(hepatocellular carcinoma, HCC)是全球第四大致命性恶性肿瘤,其致病原因有很多,其中包括非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis, NASH)。约 10%-20% 的非酒精性脂肪肝疾病会演化成 NASH,而 NASH 是导致 HCC 的高风险因素。
传统外科手术以及肝移植等方法只能治疗早期肝癌,多种激酶抑制剂以及血管内皮生长因子(vascular endothelial growth factor, VEGF)抗体药物已被批准用于治疗晚期肝癌。免疫疗法如免疫检查点抑制剂也已经被批准用于治疗 HCC,然而患者响应率只有 15-30%,且目前临床上缺乏可靠的生物标志物来对患者进行分层级来预测免疫治疗疗效。前期的研究暗示肝癌病因可能是影响免疫治疗效果的重要因素,因为不同病因对于肝肿瘤微环境和免疫调节有明显的影响。
2021 年 3 月 24 日,德国癌症研究中心的 Mathias Heikenwalder 研究团队在 Nature 上发表了题为 NASH limits anti-tumour surveillance in immunotherapy-treated HCC 的研究论文, 该工作发现在 NASH 小鼠模型的肝组织中的 CD8+ PD1+ T 细胞不仅丧失了抗肿瘤免疫监视和肿瘤杀伤功能,反而会促进 NASH 进展为 HCC,给予 NASH 小鼠 anti-PD1 治疗后增加了 HCC 的发病率。
通过单细胞转录组测序分析,研究团队在 NASH 病人肝组织中观察到了与 NASH 小鼠模型 CD8+ PD1+ T 细胞相似的表型。研究团队对于三期临床试验的荟萃分析发现免疫治疗未能改善非病毒引起的 HCC 患者的生存率。在两个额外的队列中团队观察到,与非 NASH 引起的 HCC 患者相比,NASH-HCC 患者接受 anti-PDL1 治疗后的总体生存率下降。该工作为通过病因对 HCC 患者进行分层治疗提供了理论依据。

研究内容
1. NASH 小鼠模型肝组织中 CD8+ PD1+ T 细胞增多
研究团队首先通过饲喂高脂饮食构建 NASH 小鼠模型,并对其肝脏免疫细胞绘制了单细胞聚类图谱发现 NASH 小鼠肝脏免疫细胞中 CD8 + PD1+ T 细胞强烈增多。mRNA 原位杂交实验和免疫组化分析发现肝细胞 PDL1 表达水平与 NASH 严重程度正相关。对于 CD8+ PD1+ T 细胞的质谱分析发现参与 T 细胞激活和分化、TNF 信号传导和自然杀伤(Natural Killer, NK)细胞样细胞毒性的通路富集。这些结果表明 NASH 小鼠肝脏中 CD8+ PD1+ T 细胞丰度增加,且表现衰竭和效应表型。

NASH 小鼠肝组织中 T 细胞增多暗示免疫治疗可能是 NASH 驱动的 HCC 的有效疗法。研究团队将 NASH-HCC 小鼠分成 anti-PD1 治疗组和对照组,在 anti-PD1 治疗后的 NASH-HCC 小鼠不仅没有肿瘤消退,反而观察到肝纤维化和肝癌发病率的增加,以及 cxcr6 和 tnf 基因的表达上调。在非 NASH 引起的小鼠 HCC 模型中 anti-PD1 治疗通常会引起肿瘤的消退,因此 NASH 阻碍了 HCC 免疫治疗的疗效。
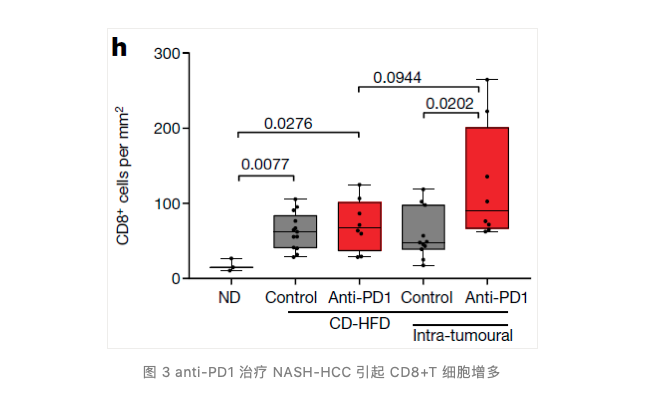
2. CD8+ T 细胞促进 NASH 进展为 HCC
由于 NASH 小鼠模型肝组织中 CD8+ T 的增多并没有带来免疫治疗效果,团队猜想这些 CD8+ T 细胞可能通过损害正常肝组织来促进 NASH 进展为 HCC。为了验证这一猜想,研究团队首先将尚未进展为 H CC 的 NASH 小鼠中 CD8+ T 细胞全部耗竭,发现 CD8+ T 细胞耗尽显著降低了小鼠肝损伤和肝癌发生率。这提示 NASH 小鼠肝脏 CD8+ T 细胞在缺乏免疫监视功能的同时,也促进了肝癌的发生。
接下来团队给予尚未进展为 HCC 的 NASH 小鼠预防性 anti-PD1 治疗,发现 anti-PD1 治疗加剧了小鼠肝损伤、肝癌发病率以及肝组织 CD8+ PD1+ T 细胞增多(TNF+PD1+CD8+T 细胞增多尤为明显),并与促进肿瘤发生的免疫抑制基因表达有很强的相关性。对于预防性 anti-PD1 治疗组 NASH 小鼠肝脏的 CD8+ PD1+ T 细胞表达谱分析发现,CD8+ PD1+ T 细胞表达高水平的效应功能和耗竭相关基因,并且发现这些 CD8+ PD1+ T 细胞缺乏增殖能力且表现出组织定居(tissue-residency)表型。这些结果表明,anti-PD1 治疗 NASH 小鼠增加肝组织中 CD8+ PD1+ T 细胞丰度,且这些细胞具有肝组织定居表型。
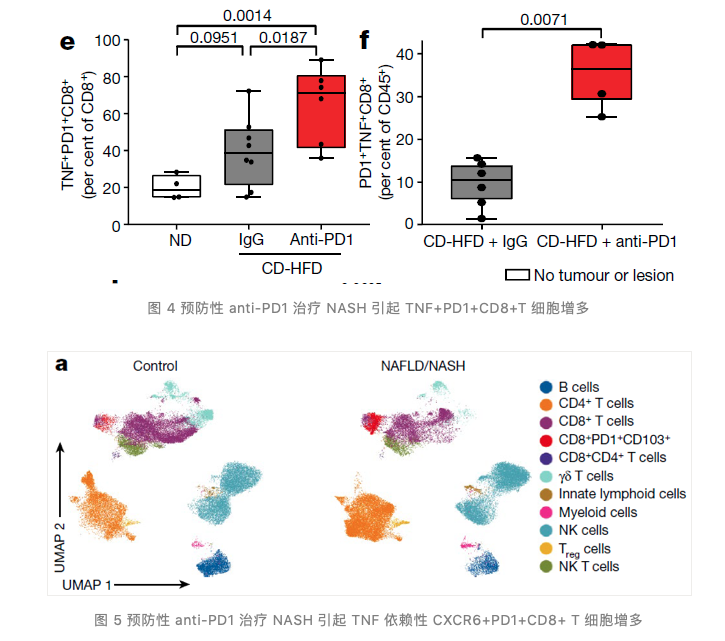
3. NASH 患者肝组织中 CD8+PD1+T 细胞增多
在 NASH 小鼠模型得到初步结论后,研究团队进一步分析了正常人以及 NASH 患者肝组织中的 T 细胞表型,发现 NASH 患者肝组织中 CD8+PD1+T 细胞增多且同样表现出肝组织定居表型。对于 NASH 患者 CD8+PD1+T 细胞进行单细胞分析,团队发现其基因表达模式与 NASH 小鼠模型中 CD8+PD1+T 细胞相似。
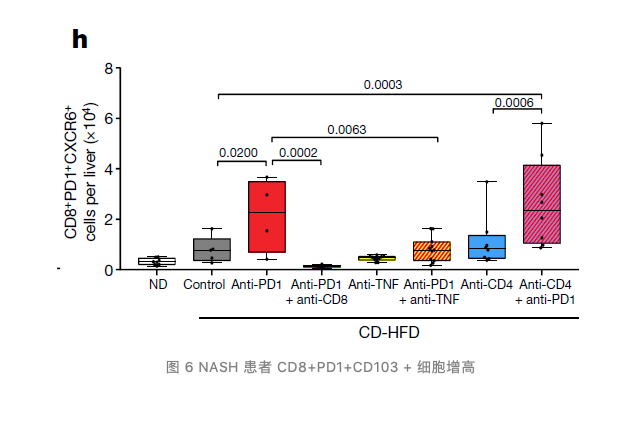
4.NASH 驱动的 HCC 患者缺乏对于免疫治疗的响应
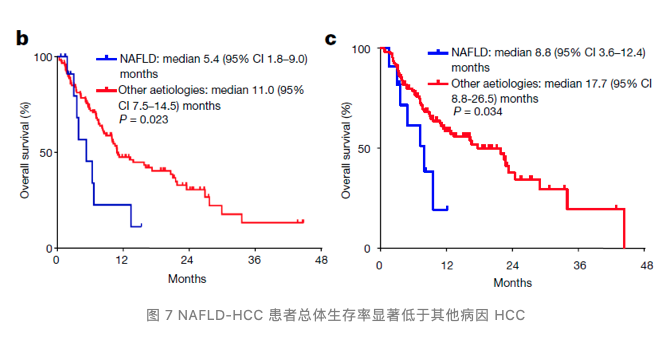
最后,团队对三个大型随机对照的晚期 HCC 患者 III 期临床试验免疫治疗进行了荟萃分析,发现尽管免疫治疗提高了患者整体的生存率,但是非病毒引起的 HCC 患者并没有从免疫治疗中获益。免疫检查点抑制剂对于由病毒原因 (HBV 或 HCV 感染) 导致肝损伤和 HCC 的患者疗效好。
团队进一步对 118 名接受 PD (L) 1 免疫治疗的 HCC 患者进行总体生存率的分析,发现与其他病因相比,非酒精性脂肪肝疾病引起的 HCC 患者接受免疫治疗的总体生存率更低。这些结果提示 NASH-HCC 患者并没有从免疫检查点抑制治疗中获益。
研究总结
总的来说,研究团队通过建立 NASH 小鼠模型以及 HCC 患者临床数据分析,结合单细胞转录组测序、免疫组化分析、质谱分析等多种实验手段,发现肝损伤和肝癌的非病毒病因(如 NASH)是免疫检查点抑制剂疗效不好的预测因素。
作者认为与非病毒性肝癌患者相比,病毒性肝癌患者对免疫治疗的更好响应可能是由于病毒抗原的数量和质量,或者由于不同病因的肝脏微环境不同,而肿瘤微环境对于免疫调节有重要作用。该工作为通过病因对 HCC 患者进行分层个性化治疗以及指导免疫检查点抑制剂治疗提供了理论依据。
值得一提的是,同期 Nature 还发表了来自慕尼黑工业大学 Percy A. Knolle 研究团队的题为 Auto-aggressive CXCR6+ CD8 T cells cause liver immune pathology in NASH 的研究论文 。
该文章发现在 NASH 小鼠模型肝组织中存在攻击自身组织的 CXCR6+CD8+ T 细胞,这一发现验证了 Mathias Heikenwalder 研究团队关于 CD8+ T 细胞可能通过损害正常肝组织来促进 NASH 进展为 HCC 的猜想。








