材料与仪器
试剂:二甲苯、梯度乙醇、抗原修复液、阻过氧化物酶断剂、山羊血清封闭剂、一抗、二抗、DAB 显色液、PBS 缓冲液、苏木素和中性树胶。
耗材:免疫组化笔、染色架、孵育盒和盖玻片。
仪器:移液器、微波炉、计时器和光学显微镜。
步骤
免疫组化染色是免疫组化实验的核心步骤之一,其目的是通过抗原抗体特异性结合以及化学反应将抗原表达情况转化为可见的颜色信号。免疫组化染色的流程包括:脱蜡水化、抗原修复、封闭、一抗孵育、二抗孵育、酶底物显色或荧光检测、封片观察等步骤。
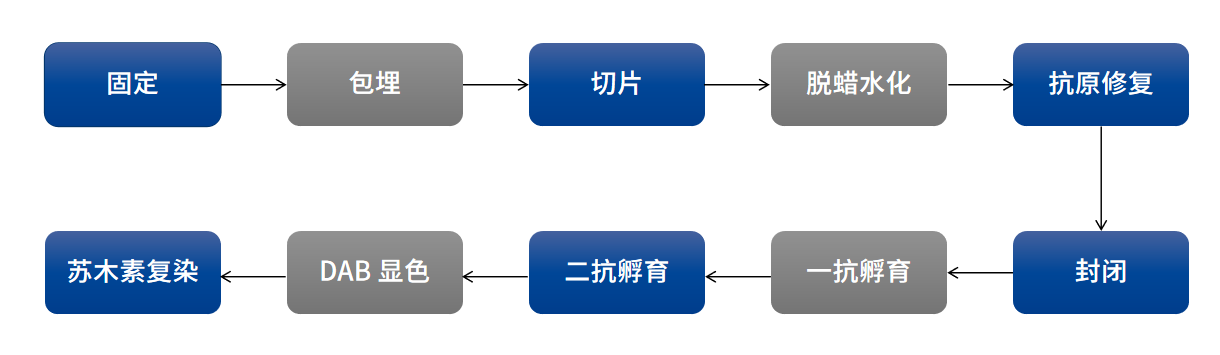
图:石蜡切片免疫组化染色流程图
以微波炉热修复为例,展示石蜡切片组化染色实验流程:
1、脱蜡处理
将石蜡切片放置于二甲苯溶液中,分为两个染色缸,依次处理 20 min/缸后,依次通过无水乙醇、95% 乙醇、90% 乙醇、80% 乙醇、70% 乙醇和 ddH2O 各处理 5 min。
2、抗原修复
根据抗原抗体情况,选择热诱导抗原修复或酶法抗原修复,以微波炉进行热诱导抗原修复为例,将脱蜡后的组织切片置于 烧杯中的切片架上,加适量抗原修复液,液面要高于切片组织,于微波炉中煮沸修复,先高火至煮沸,后中高火修复 15 min,随后自然冷却至室温,PBS 清洗 3 次,每次 3 min。
3、封闭处理
a. 阻断内源性过氧化物酶:轻甩去载玻片上的液体,用吸水纸吸干组织切片周围残留的液体。使用疏水性免疫组化笔在组织切片周围的载玻片上画一个圆圈。根据组织大小滴加适量内源性过氧化物酶阻断剂,室温孵育 10~20 min,阻断完成后用 PBS 清洗载玻片,清洗3 次,每次 3 min。
b.(可选)滴加正常山羊血清封闭液,室温 20 min。甩去多余液体。
4、一抗孵育
根据组织大小,滴加 100 μl 或适量的一抗,4℃ 过夜孵育或室温孵育 1~2 h,孵育完成后,PBS 清洗 3 次,每次 3 min。
5、二抗孵育
滴加适量微聚物二抗,室温孵育 20 min,PBS 清洗 3 次,每次 3 min。
6、DAB 显色
DAB 工作液配制:在进行 DAB 显色前配制工作液,每 1 ml DAB Buffer 加入 100 μl DAB Solution (10×),混匀后,避光保存,建议在 30 min 内用完。 滴加适量新配制 DAB 显色液,室温孵育 1~5 min,合理控制反应时间,防止染色过深,染色完成后使用 H2O冲洗 10 min。
7、复染与反蓝
苏木素染色孵育,染色完成后,使用 H2O 冲洗 10 min。
8、脱水、封片
切片置于 70% 乙醇、80% 乙醇、90% 乙醇、95% 乙醇、无水乙醇和二甲苯各 3 min脱水。将已透明处理的切片取出,滴一滴中性树胶至组织切片中央,将盖玻片一端放置于切片上,缓慢将盖玻片放下并覆盖所有组织,避免气泡产生,置于通风橱内晾干。
9、阅片
来源:丁香实验