合作专家 | 张荣钊博士
病原生物学 福建医科大学
审核专家 | 王淼博士
病原微生物 中国农业科学院
原理
将目的基因转录调控原件构建到萤火虫荧光素酶报告基因质粒上,与海肾荧光素酶内参基因质粒共转染细胞,裂解细胞后分别加入荧光素酶底物,会发出生物荧光,从而被荧光测定仪读取。
计算萤火虫荧光素酶/海肾荧光素酶的相对比值,可以判断对目的基因转录调控原件的影响。
用途
基因表达调控(如与 mRNA 靶向互作调控表达)、信号转导(验证信号通路是否激活)、转录因子的启动子结构分析等。
材料与仪器
步骤
(1) 质粒构建和转染:
构建带有目的序列的萤火虫荧光素酶报告基因,与海肾荧光素酶内参基因质粒共转染细胞,24 h 后可收获样品。
(2) 裂解:
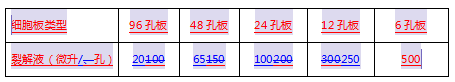
细胞用 PBS 润洗两次后,加入适量细胞裂解液(原液为 5X,用双蒸水稀释至 1X;参考体积:24 孔板每孔加入 100~150 μL,也可按下表适量加入裂解液),反复吹吸细胞,并于摇床震荡裂解 15 min,收集细胞至 1.5 mL EP 管中, 4 ℃ 10000 g 离心 10 min,取上清到新的 EP 管中。
(3) 配置反应底物:
① 配置萤火虫荧光素酶的底物 1(S1):试剂盒首次使用时即配置,将底物 buffer 加入装有固体底物的棕色瓶中,溶解摇匀,按每次实验需求量(如 1 mL/EP 管)分装于 -80 ℃ 避光保存,使用时室温溶解,同样避光。计算样品数量,按每 50 μL 测定一个样品,分装至 EP 管中。
② 配置海肾荧光素酶的底物 stop&Glo(S2):每 50 μL stop buffer 加入 1 μL stop substrate。根据样品数量,按每 50 μL 测定一个样品,按需配置。
(4) 测量读值:
取待检测样品 10 μL 加入到 50 μL 反应底物 S1 中,用移液器轻轻吹打数下(注意避免产生气泡),迅速放置仪器中检测(EP 管开盖测量),测得第一个数值(萤火虫荧光素酶活性 S1)。
完毕后迅速将 EP 管取出,加入 50 μL stop&Glo 液,用移液器轻轻吹打混匀,迅速放入仪器中,测得第二个数值(海肾荧光素酶活性 S2)。
上述操作完成后,仪器所显示的二者的比值即为所需数据。
注意事项
(1) 萤火虫荧光素酶底物按需分装以避免反复冻融,-80 ℃ 避光保存,海肾荧光素酶底物现配现用。
(2) 实验前各个组分(细胞裂解产物,底物工作液等)都需要恢复到室温,实验操作过程中注意避光,整个过程尽量在 30 min 内完成,每个样品需充分混匀,并且混匀次数和时间尽量保持一致。
(3) 如果细胞裂解产物需要暂存,常温不超过 6 小时,-20 ℃ 一个月,-80 ℃ 半年。
常见问题
(1) 测量的荧光值较低。首先排除转染效率问题,12 孔板多铺一孔细胞转染荧光质粒,观察转染的荧光效率,并设立阳性和阴性对照。排除转染问题后,如果荧光读值仍然较低,可以尝试增加转染质粒量。
(2) 测量的荧光值过高。减少转染质粒量,或者适当稀释细胞裂解离心后的上清液。
来源:丁香实验







