合作专家 | 郭新容硕士
临床医学 中南大学
审核专家 | 李娜硕士
生理学 大连医科大学
简介
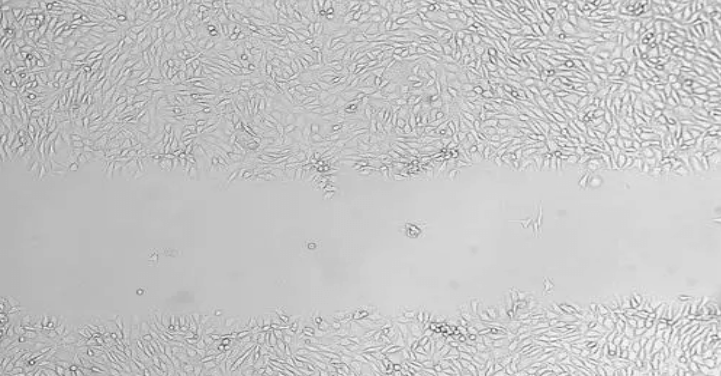
在融合的单层细胞上人为制造一个空白区域,称为「划痕/伤口」,边缘的细胞会逐渐进入空白区域使「划痕/伤口」愈合。
用途
广泛用于可以观察药物、基因等外源因素对细胞迁移和修复的影响。
材料与仪器
步骤
1、培养板划线标记
用 marker 笔在 6 孔板背后画横线(用直尺比着),大约每隔 0.5~1 cm 一道,每孔至少横穿 5 条线。
2、细胞铺板
在孔内接种约 5-10×105 个细胞,根据具体细胞特性调整细胞数量,保证实验时细胞密度近 100% 单层细胞状态。
3、细胞划线
第二天用 20 uL 枪头(灭菌),垂直孔板背后的黑线划痕,使划痕与标记线相交。
4、洗细胞
使用无菌 PBS 洗细胞 2~3 次,去除划下的细胞,使留下的间隙肉眼即清晰可见,然后更换新鲜无血清或低血清(< 2%)的培养基。
5、细胞培养与观察
将细胞放入 37 ℃,5% CO2 培养箱中培养。然后在适当的时间点,如 0,6,12,24 小时后取出细胞,在显微镜下观察并拍照。
6、数据分析
使用 Image J 软件打开图片后,随机划取 6 至 8 条水平线,计算细胞间距离的均值。
注意事项
1、细胞铺板根据细胞的生长快慢调整接种数量,原则为过夜后细胞能够长满,切记一定要铺匀。
2、减少划痕距离的误差办法:不同孔之间最好使用同一只枪头;枪头要垂直,不能倾斜,划痕时可比着直尺;保持力度一致,尽量一次性划完。
3、在用 PBS 缓冲液冲洗细胞时,注意贴壁慢慢加入,以免冲散单层贴壁细胞;为了避免细胞数量和状态受到影响,可用移液枪缓慢吸走。
4、孔板选择:因为 6 孔板大小适中,可保证有相当距离的平直划痕,便于观察,故一般选择 6 孔板;当然若是需要高通量初筛时,也可以用 12 或 24 孔板。
5、细胞的接种密度原则一般是过夜为 100% 融合,若过夜后细胞未 100% 融合,虽可以适当延长培养时间,但因细胞密度已经很大,所以细胞状态会逐渐变差,后续细胞可能不迁移而是凋亡。
6、降低细胞增殖对迁移造成的假阳性结果的方法:
① 使用无血清或低血清培养基(< 2%)可降低细胞增殖对实验结果的影响;
② 一般认为 24 h 为细胞的一个周期,在选取合适的时间点(6,12,24 h)检测划痕宽度时,最好不要超过细胞一个周期的时间;
③ 如果要单纯考虑细胞迁移,可以先用丝裂霉素(1 μg/ml)处理 1 h,抑制细胞的分裂。
7、确保拍照的观察点固定:按照 6 孔板背后画线的垂直方向划痕,可以形成若干交叉点,划痕一次与 5 条定位线相交,就有 10 个可固定监测点,以解决了前后观察时位置不固定的问题。
来源:丁香实验







