简介
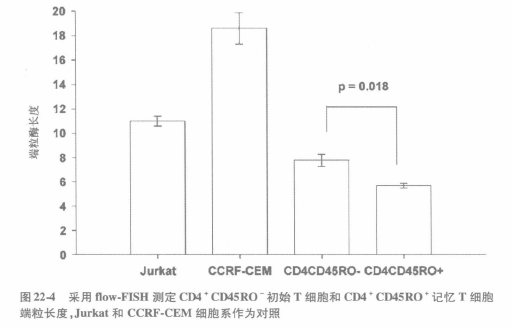
用流式细胞仪测量端粒长度或任何细胞特征的最大优点在于它可以针对同一细胞群同时分析多参数。因此在测定端粒长度时,可以同时标记细胞表面标志,这是一种很有价值的方法,可以鉴别不同免疫细胞群体中的端粒长度。如果采用上述的方法对于复杂的血细胞或组织样品来说,在检测不同细胞群体的端粒长度前必须依据自身特征进行分离(如图 22-4 所示那样先分离初始和记忆 T 细胞亚群)。采用荧光素偶联的抗体进行免疫荧光表型分析就不必对细胞进行亚群分离了。然而测定端粒长度过程中,细胞要孵育到 82 ℃,许多荧光素和抗原抗体复合物不可能经受得了如此条件。最近,Batliwalla 等报道了一个新的方法,采用单色标记细胞表面标志与端粒的长度测定相结合。低分子量花青素单体 Cy5 荧光素探针(Amersham 生物科学公司,皮斯卡塔韦,新泽西州)作为第二标记物,因为其在高温时很稳定。此外,采用共价交联试剂稳定抗体和细胞表面抗原复合物,保护其避免热效应。
材料与仪器
器材:能加热到 40 ℃ 和 82 ℃ 水浴或金属浴装置、离心机、涡旋混合器、1.5 mL Eppendorf 离心管、一次性 12 mm × 75 mm 聚苯乙烯管、细胞计数器或血细胞计数仪、双激光(带 488 nm 氩离子和 633 nm 红色氦氖或 635 nm 红色二极管激光器)流式细胞仪等。
试剂:
① 磷酸盐缓冲液(PBS)不含 Ca2+ 和 Mg2+。
② 牛血清白蛋白(Bovine serum albumin,BSA)。
③ QuantumTM 24 预混合的与可溶性荧光素分子相当的异硫氰酸荧光素(FITC MESF)珠(彭斯实验室,Fishers 公司;前流式细胞仪标准公司,圣胡安,波多黎各)。
④ 用于端粒重复序列检测的肽核酸荧光探针(peptide nucleic acid,PNA):荧光素偶联的合成的特异性 PNA 探针(PerSeptive Biosystems,福雷明罕,马萨诸塞州;Boston probes,贝德福德,马萨诸塞州),或者购买试剂盒,端粒 PNA 试剂盒/FITC(DAKO 公司,卡平特里亚,加利福尼亚)。
⑤ 杂交缓冲液:70% 甲酰胺,20 mM Tris-HCl,pH7.0,1% BSA,含有或不含有 0.3 μg/ml 的 PNA 探针。
⑥ 洗涤缓冲液:70% 甲酰胺,20 mM Tris-HCl,pH7.0,1% BSA,0.1% 吐温-20。
⑦ 含 DNA 的重悬缓冲液:PBS,0.1% BSA,碘化丙啶(propidium iodide,PI)0.06 μg/ml 其中含无 DNA 酶的 RNA 酶 A 10 μg/ml,或者 7-氨基放线菌素 D(7-aminoactinomycin D,7-AAD)0.01 μg/ml 其中不含 RNA 酶 A。
⑧ BS3[双(磺基琥珀酰亚胺)辛二酸盐](Pierce 公司,罗克福德,伊利诺州):该试剂用于在热变性之前将表型抗体交联到细胞表面。其粉剂应保持干燥储存于 - 20 ℃。BS3 溶液配制后应该立即使用,剩下的废弃。
⑨ 终止缓冲液:100 mM 的 Tris-HCl,pH7.0 以及 150 mM 的 NaCl。
⑩ 针对意向的细胞表面标志的 Cy5 标记的抗体(见注释 4.7):Cy5 标记的二抗和链霉亲和素可以从 Caltag 公司(伯林盖姆,加利福尼亚州)或 Jackson 免疫研究公司(西格罗夫,宾夕法尼亚州)获得。把 Cy5 与多种抗体直接偶联试剂盒可以从 Amersham 公司购得。
步骤
基于细胞表型的端粒长度定量的测定方法的基本过程可分为如下几步:
(一)定标和校正
目前用来标记端粒的 FISH 技术依赖于模仿端粒序列互补的特异性 DNA 序列合成的特异性肽探针。这些合成的探针上标记低分子量的荧光素,其可以通过流式细胞仪检测与端粒位点非共价结合的探针数对端粒进行定量。端粒重复序列特异性 PNA 探针的序列是 [(CCCTAA)3-PNA],这个序列已被证明对于 FISH 法测定端粒长度来说是非常可靠的。PNA 探针与传统的 cDNA 寡核苷酸探针相比有许多优越性,包括减少与 DNA 的非特异性结合,有抗核酸酶的功能以及与端粒序列结合强而稳定等特点。通过与 Southern blotting 数据相比较,根据经验确定的 PNA 探针与荧光及适当的端粒重复序列数结合的数学模式能适用于多种细胞中;然而,对于每台流式细胞仪和直接相关的某些内源性荧光值来说,定量每个端粒重复序列非共价结合的 PNA 探针数量需要进行校准和标准化。这样这些绝对的荧光值才可以换算成以 kbs 为单位的端粒长度。
A 标准化试验和 MESF 校准
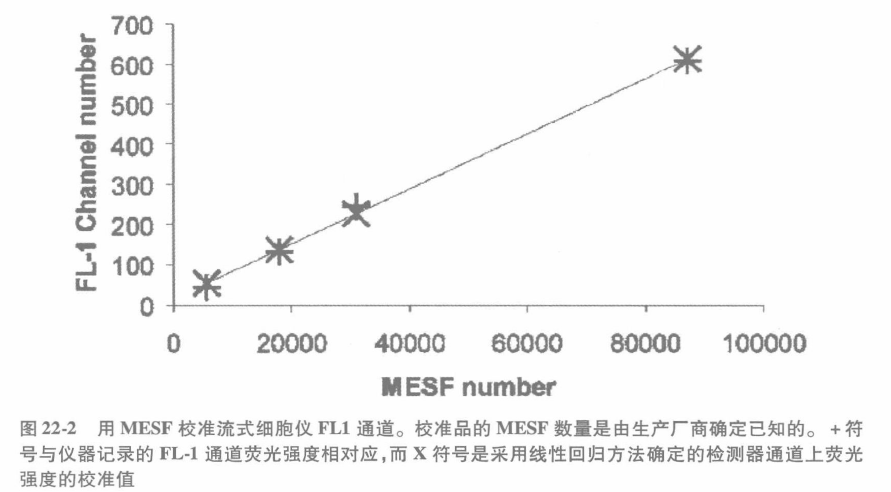
为了弥补存在于流式细胞仪与日常属性(激光强度,组合的变化,等)误差,必须有一套标准化的校准程序来确保端粒长度定量测定的准确性。QuantumTM 24 预混荧光 MESF 珠常用来校准每台仪器和建立基于荧光测定的标准曲线。这些珠子表面结合的荧光素分子数量是已知的,可以用来校准流式细胞仪和确定的标准曲线。因此这些颗粒在流式细胞仪上的荧光强度值与实际的荧光素分子数相关联;如果偶联在 PNA 探针上的荧光素分子数量是已知的话,那么通过将相对荧光信号强度与每个细胞结合的 PNA 探针数量(即端粒重复序列数量)相关联就可以建立一条标准的荧光曲线。实例如图 22-1 和图 22-2 所示,流式细胞仪分析显示了未标记和标记 [如 FITC 或藻红蛋白(PE)标记] 的 MESF 珠混合物随着结合的大量荧光素分子逐渐增加而荧光强度不断增强。

① 调整未标记的珠在流式细胞仪荧光通道标尺数值的 1~10(4 个对数值的第 1 个 10 的对数值内)。
② 在同一个仪器设置下分析混合的不同荧光强度的 MESF 珠(图 22-1)。假设流式细胞仪检测器能够在整个动态过程中做出线性的测量,那么理想的情况下不同的 MESF 珠荧光强度荧光呈线性分布(图 22-2)。
③ 用以下线性回归方程式计算出 MESF 珠数量(MESF 值)与荧光通道上荧光强度数值(FLchannel 值)之间的线性关系:
FLchannel 值 - FLchannel 值(空白)= 斜率 × MESF 值
在端粒长度检测中,对每台流式细胞仪的检测器与所用的荧光素(如 PE)的线性关系进行评估是必要的。线性回归曲线的斜率如图 22-2 所示同样也随之被确定,并应用于端粒的长度的测定。理想的方法是每次 flow-FISH 检测时均应掺入 MESF 珠进行校准,从而确定仪器日常变异系数。
B 用转换曲线校准端粒的长度
① Rufer 等曾经计算对不同的淋巴细胞亚群采用 FITC 标记的 PNA 探针的 flow-FISH 方法测定端粒的荧光强度与 Southern blot 测定端粒长度之间的相关系数。这个相关系数适合于多种类型细胞的端粒长度测定。在这个系统中,对于流式细胞仪通道上的数值而言可以用下述方程对 FITC 荧光强度进行任意量化:
端粒的长度(kb)= 0.019 ×[FLchannel 值 - FLchannel 值(空白)]
② 随后 Rufer 等在采用之前所述的 FITC 标记的 MESF 珠校准 FITC 通道数值方法的研究中使用了一个更适合于定量的系统。把 MESF 珠的荧光强度值作为标准单位来取代任意量化的 FITC 通道荧光强度值,因此可用下列公式以 MESF 单位来表示由 Southern blot 检测到的端粒长度:
FLchannel 值 - FLchannel 值(空白)= MESF × 0.02604
③ 由公式 2 和 3 消除任意定化单位,可以推算出用标准 MESF 单位来表示端粒长度的最终表达式:
端粒的长度(kb)= MESF × 0.019 × 0.02604
假如校准所采用的是相同的标准化 MESF 珠,那么这个公式就不依赖于所采用的流式细胞仪。
④ 由公式 1 和 4 消除 MESF 单位,可以得出直接校准流式细胞仪 FITC 通道值,采用 flow-FISH 方法测定端粒长度计算公式:
端粒的长度(kb)=
(FLchannel 值 - FLchannel 值 [空白])× 0.019 × 0.02604/斜率
(二)细胞表面标记
A 计数 1 × 106 个细胞用针对意向的细胞表面标志的 Cy5 直标抗体或生物素标记抗体于 4 ℃ 标记 25 min。
B 如果使用直标抗体,离心,用 4 ml 含有 0.1% BSA 的 PBS 洗涤,然后重悬于 100 μl 的 PBS 中。如果应用生物素标记的抗体,用链霉亲和素标记的 Cy5 做第二步标记。
(三)抗体的交叉反应
在 82 ℃ 变性之前,Cy5 标记的复合物与 BS3 交联,以稳定复合物。BS3 是水溶性的,主要起到耦联伯胺的作用。其通过共价键把抗体-荧光素复合物连接到细胞表面。
A 用 PBS 配置浓度为 2 mM 的 BS3 的储存液。由于 BS3 在水中迅速的水解,每次试验前 BS3 都必须新鲜制备。耦联细胞时,加入等体积的 BS3 溶液重悬细胞(通常为 100 μl)并置 4 ℃ 孵育 30 min。
B 灭活过量的 BS3,加 1 ml 终止缓冲液,孵育 20 min。
C 离心细胞后按照以下①~④步骤继续。试验开始和结束时都必须检查流式细胞仪的校准和线性设置。
① 在上细胞样品前,先将荧光 MESF 珠上机,按照小标题「(一)定标和校正」第 A 步骤所述建立荧光标准曲线。
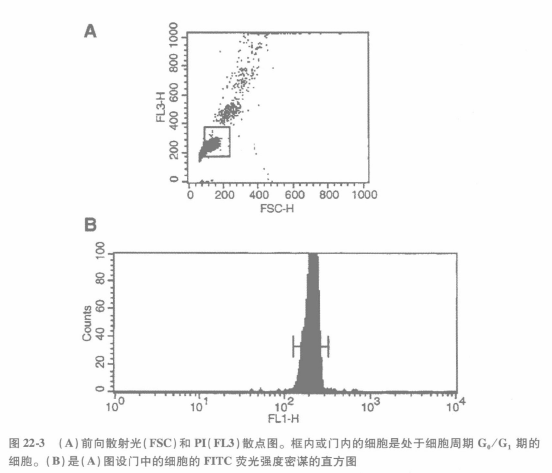
② 分析样品,保持 FITC 探测器(通常设定为 FL1)的电压设置与 MESF 珠定标时相同设置。开始,用前向散射(FSC)和 DNA 染料荧光来观察细胞,2 个坐标均采用线性标尺(图 22-3A)。对于 PI 和 7-AAD 荧光,通常采用长波红色荧光探测器检测。FSC 和 DNA 染料荧光检测探测器的电压设置可以与 MESF 珠定标时有所改变。所有的荧光补偿都应该置为零。
③ 针对处于 G0/G1,期的细胞设门,把门内这群细胞的 FITC 的荧光用柱状图来表示出来(见图 22-3B)。
④ 用表格式文件记录数据,其中包括在设定参数条件下 FSC(线性),DNA 染料(线性)和 PNA 探针荧光(对数)的数值。
(四)流式细胞仪和数据分析
A 分析样品的前向散射和 DNA 染料的荧光,对处于 G0/G1,期的单个细胞群体设门分析。
B 设置合适的荧光通道,用直方图分析门内 G0/G1,期细胞群 Cy5 荧光,对 Cy5 阳性细胞设门分析。
C 在 FITC PNA 探针的直方图中分析该门内处于 G0/G1,期的 Cy5+ 细胞群的探针的荧光强度。
D 计算端粒的长度。
来源:丁香实验