简介
哺乳动物蛋白-蛋白相互作用陷阱系统(MAPPIT)是基于对 I 型细胞因子受体信号传导机制的认识而设计的双杂交系统。“诱饵”多肽和 “猎物” 多肽与突变细胞因子受体嵌合体连在一起,后者的信号传导是受损的。在相应的配体刺激后,如果“诱饵”与“猎物”能相互作用结合,JAK-STAT 信号级联放大系统启动,诱导受控于 STAT3 响应 rPAP1(rat pancreatitis associat-ed protein 1)启动子下的报告基因或标记基因大量转录。除了为哺乳动物蛋白 - 蛋白相互作用系统提供相关的生理环境外,这种方法也提供了分隔的作用区和效应区,能被用于分析和筛选目的。
原理
哺乳动物蛋白 - 蛋白相互作用陷阱系统(MAPPIT)的基本原理是“诱饵”多肽和“猎物”多肽与突变细胞因子受体嵌合体连在一起,后者的信号传导是受损的。在相应的配体刺激后,如果“诱饵”与“猎物”能相互作用结合,JAK-STAT 信号级联放大系统启动,诱导受控于 STAT3 响应 rPAP1(rat pancreatitis associat-ed protein 1)启动子下的报告基因或标记基因大量转录,这种方法提供了分隔的作用区和效应区,结合流式细胞术可用于分析和筛选细胞。
材料与仪器
步骤
以荧光激活细胞分选技术为基础的哺乳动物蛋白-蛋白相互作用陷阱系统建立的基本过程可分为如下几步:
1 常用筛选材料的准备
1.1 用于 FACS 方法 cDNA 文库筛选的细胞株改造
采用人 IL-5 受体 α 亚单位,在建立的表达复合体中,hIL-5Rα 表面标记受 STAT3 依赖的 rPAP1 启动子控制。共转染 HEK 293 Flp-In T-REx 细胞后,选择稳定整合了表达复合体与 EcoR 表达体的克隆。用白血病抑制因子刺激后(通过内源性表达受体经 STAT3 途径传递信号),流式细胞仪检测 hIL-5Ra 水平。在检测中,分别采用 α16 和 AlexaFluor488 标记的抗鼠 IgG 作为一抗和二抗。
1.2 受体-诱饵嵌合体的表达载体
用于受体-诱饵复合体的表达的 pCELIf 和 pCLL1f 载体来源于 peDNA5/FRT 质粒(Flp-In 系统),后者包含 FRT 位点,并与潮霉素耐药基因相连,耐药基因为了 Flp 重组酶能够整合进 T-Rex44 宿主细胞并进行筛选稳定细胞株。融合受体表达受人巨细胞病毒启动子的控制。pCEL1f 和 pCLL1f 质粒在嵌合受体的胞外区的性质不同,嵌合受体来源于人促红细胞生成素受体(EpoR)或鼠瘦素受体(LR))。两种嵌合受体进一步与瘦素受体变异体的跨膜和胞内部分连接,后者的酪氨酸被替换成苯丙氨酸(LR-F3)。用 SacI 和 Notl 限制性酶切位点,将诱饵蛋白(片段)克隆在一短铰链序列之后。
当诱饵载体和 Flp 重组酶表达质粒 POG44(Invitrogen)共转染后,在诱饵载体的 FRT 位点和宿主细胞基因组之间发生重组导致博来霉素抗性向潮霉素抗性的转换(通过在 LacZ-Zeocin 融合基因前诱导一个多聚腺苷酸信号序列),并稳定表达受体-诱饵嵌合体。(B)pBG1 猎物载体简图。这个载体包括 E.coli ccdB 反向选择复合体,易于 cDNA 文库增殖。
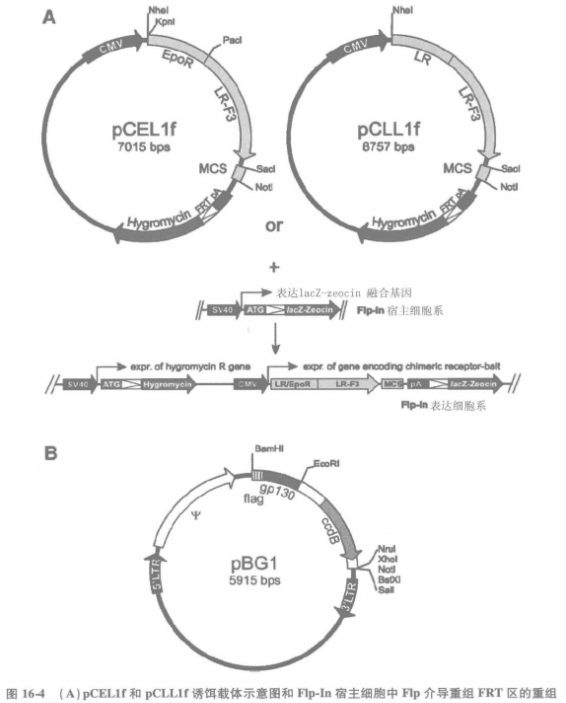
1.3 猎物 cDNA 文库
猎物 cDNA 文库从 pBG1 中获取,后者衍生于 pBABE(一种鼠逆转录病毒载体,包含 Molo-ney 白血病病毒长末段重复序列和ψ序列)。PBG1 质粒编码一个 FLAG 标签 gp130 片段,后者有 GGS(甘-甘-丝)氨基酸连接区,其后是多克隆位点,用 EcoRI 和 Notl 或 Xhol 酶切位点可把 cDNA 单向克隆进去。为了能够对自连质粒反向选择,整合的猎物序列去除了编码细菌 ccdB 蛋白(control of cell death B)的填充序列。Oligo(dT)或随机引物 cDNA 或两者结合的文库,都能被用于筛选。
2 筛选准备
2.1 稳定表达受体-诱饵融合体的同基因细胞池建立
受体-诱饵嵌合表达载体被转染到 T-Rex44 细胞中,按照说明筛选稳定表达融合蛋白的同基因细胞池。细胞膜表达的受体-诱饵蛋白嵌合体通过 FACS 分析加以确认。
2.1.1 10 cm2 组织培养板中接种 4x105 同基因细胞,加 2 ml 培养液(包括阴性对照亲代 FRex 44 细胞),37 ℃,8%~10% CO2 过夜。
2.1.2 用 500 μl 细胞消化液分离细胞。
2.1.3 去除消化液,加入 500 μl FACS 缓冲液,2 min,150 g 离心收集细胞。
2.1.4 用 100 μl FACS 缓冲液重悬细胞,加入针对受体-诱饵融合体的胞外部分的抗体(我们在使用 PCELIf 载体表达时,用终浓度 2 μg/ml 的羊抗人 EpoR 多抗后使用 PCLLIf 表达载体时用终浓度为 3 μg/ml 的自制大鼠抗小鼠 LR 单抗隆抗体 4A9 或 1 G2),4 ℃,2 h,旋转混合仪混合。
2.1.5 小心洗涤细胞:加 900 μl 的 FACS 缓冲液,150 g 离心 2 min,再加入 500 μl 的 FACS 缓冲液,轻轻涡旋混匀,再 150 g 离心 2 min。
2.1.6 用 100 μl 的 FACS 缓冲液重悬细胞,加入适合的荧光素耦联二抗(我们用 Alexa Fluor488 耦联抗体),4 ℃,45 min。
2.1.7 900 μl 的 FACS 缓冲液洗细胞,150 g 离心 2 min。
2.1.8 250 μl 的 FACS 缓冲液重悬细胞,加入 3 μM 碘化丙啶。
2.1.9 FACS 分析,测定受体-诱饵融合体的表达。
2.2 筛选条件的确定
为了能够进行 MACS 预分选,携带 hIL-5Ra 表面标记的细胞先用生物素化的 α16 标记,再用抗生物素-抗体耦联的 MACS 微球反应。细胞通过放置在强磁场的分离柱中,进行分离,流出的细胞是高度富集的阳性细胞。MACS 预分选的优点可以去除一些猎物非依赖性的 hIL-5Rα 表达降低的细胞。不同的诱饵可能背景不同,应该针对每个诱饵蛋白确定理想的信-噪比的筛选条件。
2.2.1 为了检验每个筛选条件,以及阴性和阳性对照,在 75 cm2 的组织培养瓶中种入 5 ×106 的同基因细胞,加入 20 ml 培养液,37 ℃ 8%~10% 的 CO2 过夜。
2.2.2 按照检验的筛选条件,加入 Epo 或瘦素,37 ℃,8%~10% 的 CO2,24 h。
2.2.3 用消化液消化细胞,收集,通过 70 μm 的细胞滤器过滤。
2.2.4 用 FACS 缓冲液稀释消化液,离心收集细胞。
2.2.5 用 FACS 缓冲液重悬细胞,至浓度为 10 细胞/ml,加入生物素化的 α16 抗体(终浓度为 1 μg/ml),4 ℃,旋转混合仪混合 2 h。
2.2.6 小心洗涤细胞:加 10~20 倍体积的 FACS 缓冲液,500 g,离心 3 min,用 FACS 缓冲液重悬细胞,500 g 再离心 3 min。
2.2.7 每 107 个细胞用 80 μl 的 FACS 缓冲液重悬细胞,加入 20 μl 抗生物素抗体 MACS 微球,涡旋仪轻轻混匀,6~12 ℃,孵育 15 min。
2.2.8 洗涤细胞:10~20 倍体积的 FACS 缓冲液体积,500 g,离心 3 min,用 FACS 缓冲液重悬细胞,再次 500 g,离心 3 min。
2.2.9 每 10 个细胞,加入 500 μl 去空气的 FACS 缓冲液重悬细胞,最少用 1 ml。
2.2.10 按照制造商说明书,进行 MACS 分选:将 LS 柱放置于 MACS 分选磁铁上,用 3 ml FACS 缓冲液洗柱子。
2.2.11 细胞经通过 70 μm 细胞过滤网过滤后,将细胞加入 MACS 柱,收集流出液。
2.2.12 用 3 ml FACS 缓冲液洗柱子 3 次。与前一步一样收集流出液(将洗脱组分含并)。
2.2.13 把柱子从分离器上取下,加 5 ml 去空气的 FACS 缓冲液,用针管把细胞挤出收集于一个收集管中(这是样品分选的部分)。
2.2.14 细胞 500 g 离心 3 min 后,用 FACS 缓冲液重悬细胞,加合适的荧光素标记的二抗(我们常用 AlexaFluar488 耦联的抗小鼠 IgG 抗体,10/细胞加终浓度 1.3 μg/ml 的二抗),4 ℃,用旋转混合仪混合 45 min。
2.2.15 加 10~20 倍体积的 FACS 缓冲液 500 g,3 min,洗涤细胞。
2.2.16 用 FACS 缓冲液重悬细胞,加 3μM 的碘化丙啶。
2.2.17 用 FACS 分析 hIL-5Rα 标记表达的背景含量,并记录下洗出组分和分选组分中的细胞数,以便分析不同筛选条件下的回收率。
3 筛选
3.1 逆转录病毒感染和刺激
3.1.1 种 10 同基因细胞至 175 cm2 组织培养瓶中,加 20 ml 培养基,37 ℃,8%~10% CO2,孵育 5 h。
3.1.2 加入终浓度为 2.5 μg/ml 的聚凝胺,加入合适稀释度的含有 cDNA 文库的病毒颗粒。同时准备至少一瓶的模拟转染的细胞,作为 FACS 分析时的对照。
3.1.3 37 ℃,8%~10% CO2 培养过夜。
3.1.4 换培养液,并加入 Epo 或瘦素(有/或毛喉素)。
3.1.5 37℃,8%~10% CO2 培养过夜。
3.2 MACS 预分选和 FACS 单细胞分选
3.2.1 按照小标题 2.2 的步骤 3~10 准备 MACS 分选细胞。
3.2.2 将 LS 柱放置于 MACS 分离磁铁中,用 3 ml 去气体 FACS 缓冲液洗柱子。
3.2.3 将细胞用 70 μm 细胞过滤网过滤,然后加(1~10 ml)于分离柱中。
3.2.4 用 3 ml 去空气 FACS 缓冲液洗柱子 3 次。
3.2.5 把柱子从分离器上取下,加 5 ml 去空气 FACS 缓冲液,用针管把细胞挤入一个收集管中。
3.2.6 细胞 500 g 离心 3 min 后,用 FACS 缓冲液重悬细胞,加合适荧光素标记的二抗(我们 10/ml 细胞,用终浓度 1.3 μg/ml 的 AlexaFluor488 耦联的抗小鼠 IgG 抗体),4 ℃,旋转混合仪混合 45 min。
3.2.7 加 10~20 倍体积的 FACS 缓冲液 500 g,3 min,洗细胞。
3.2.8 用 FACS 缓冲液重悬细胞至 106/1 ml 细胞。
3.2.9 用非转染的样品作为对照,进行流式细胞分选设门。把阳性细胞收集在不同的管或多孔板中,管或板中含终浓度为 100 U/ml 的青霉素和 100 μg/ml 的链霉素,上机分选。
4 分选细胞的进一步处理
4.1 相互作用蛋白的功能分析
由于诱饵和猎物嵌合蛋白在筛选的克隆中都稳定表达,故这些克隆转染了 rPAP 荧光素酶报告基因能够用于证实诱饵-猎物间的相互作用。与这些报告基因一起,不同的受体-诱饵构件体转染后,都能被筛选出一些假阳性。例如,当用受体-诱饵嵌合体筛选时,此与 EPOR 的胞外部分是嵌合的,那么变异体如包含 LR 胞外部分的嵌合体就能被用于剔除非 EPO 依赖的相互作用。通过与缺乏诱饵的建构体共转染,可检测出诱饵依赖性的蛋白相互作用。
4.2 猎物的识别
用常规方法扩增猎物特异性序列,可以用基因组 DNA 进行 PCR,也可以用一步法或二步法的 RT-PCR。用针对 gp130 的侧翼和逆转录病毒 3’末段重复序列的特异性引物进行 PCR。当用前向 gp130 特异性引物:5'GGCATGGAGGCTGCGACTG-3',反向 3'末段重复序列特异性引物:5'-TCGTCGACCACTGTGCTGGC-3',退火温度为 70 ℃ 时,能有效地进行 PCR 扩增。在 PCR 过程中,应注意避免污染而产生假阳性条带。因此操作应在层流柜中进行,所有的耗材和试剂应没有模板污染。琼脂糖电泳分离后,回收特异性条带,用 gp130 特异性引物进行测序。
来源:丁香实验