简介
分子标记(molecular marker)是遗传标记(genetic marker)的一种,是在基因水平上的标记,直接在 DNA 分子上检测遗传变异,用作指示基因组范围变化的多态性标记。分子标记能对不同发育时期的个体、任何组织器官甚至细胞作检测,数量极多,遍及整个基因组,多态性高,遗传稳定,不受环境及基因表达与否的限制,正是因为这些优点,分子标记的应用越来越广泛。它包括 RFLP、RAPD、AFLP、SSR 等。
长期以来,植物学研究中选择都是基于表型性状、形态学、结构等方面进行的,当性状的遗传基础较为简单或即使较为复杂但表现加性基因遗传效应时,表型选择是有效的。但物种的许多重要表型性状为数量性状,如产量等;或多基因控制的质量性状,如抗性等;或表型难以准确鉴定的性状,如根系活力等。此时根据表型提供的对性状遗传潜力的度量是不确切的,因而选择是低效的。分子生物学技术的发展为植物科学研究提供了一种基于 DNA 变异的新型遗传标记——DNA 分子标记,或简称分子标记。与传统应用的常规遗传标记相比,分子标记具有许多明显的优点,因而已被广泛应用于现代植物研究的各个方面,大量以前无法进行的研究目前利用分子标记手段正蓬勃开展,并取得了丰硕的成果。尤其是当分子标记技术与传统形态结构紧密结合后,正在为植物科学技术带来一场新的变革。
分子标记大多以电泳谱带的形式表现,大致可分为 3 大类:第一类是以分子杂交为核心的分子标记技术,包括限制性片段长度多态性(restriction fragment length polymorphism,RFLP)标记、DNA 指纹(DNA fingerprinting)技术、原位杂交(in situ hybridization)等;第二类是以聚合酶链反应(polymerase chain reaction,PCR)反应为核心的分子标记技术,包括随机扩增多态性 DNA(random amplification polymorphism DNA,RAPD)标记、简单序列重复(simple sequence repeat,SSR)标记或简单序列长度多态性(simple sequence length polymorphism,SSLP)标记、扩增片段长度多态性(amplified fragment length polymorphism,AFLP)标记、序标位(sequence tagged sites,STS)标记、序列特征化扩增区域(sequence charactered amplified region,SCAR)标记等;第三类是一些新型的分子标记,如单核昔酸多态性(single nucleotide polymorphism,SNP)标记、表达序列标签(expressed sequences tags,EST)标记等。以下将介绍其中最常用的一些标记技术。
原理
广义同工酶是指生物体内催化相同反应而分子结构不同的酶。存在于同一种属或不同种属,同一个体的不同组织或同一组织、同一细胞,具有不同分子形式但却能催化相同的化学反应的一组酶,称为同工酶(isoenzyme)。同工酶的基因先转录成同工酶的信使核糖核酸(mRNA),后者再翻译产生同工酶的肽链,不同的肽链可以不聚合的单体形式存在,也可聚合成纯聚体或杂交体,从而形成同一种酶的不同结构形式(图 42-1A)。
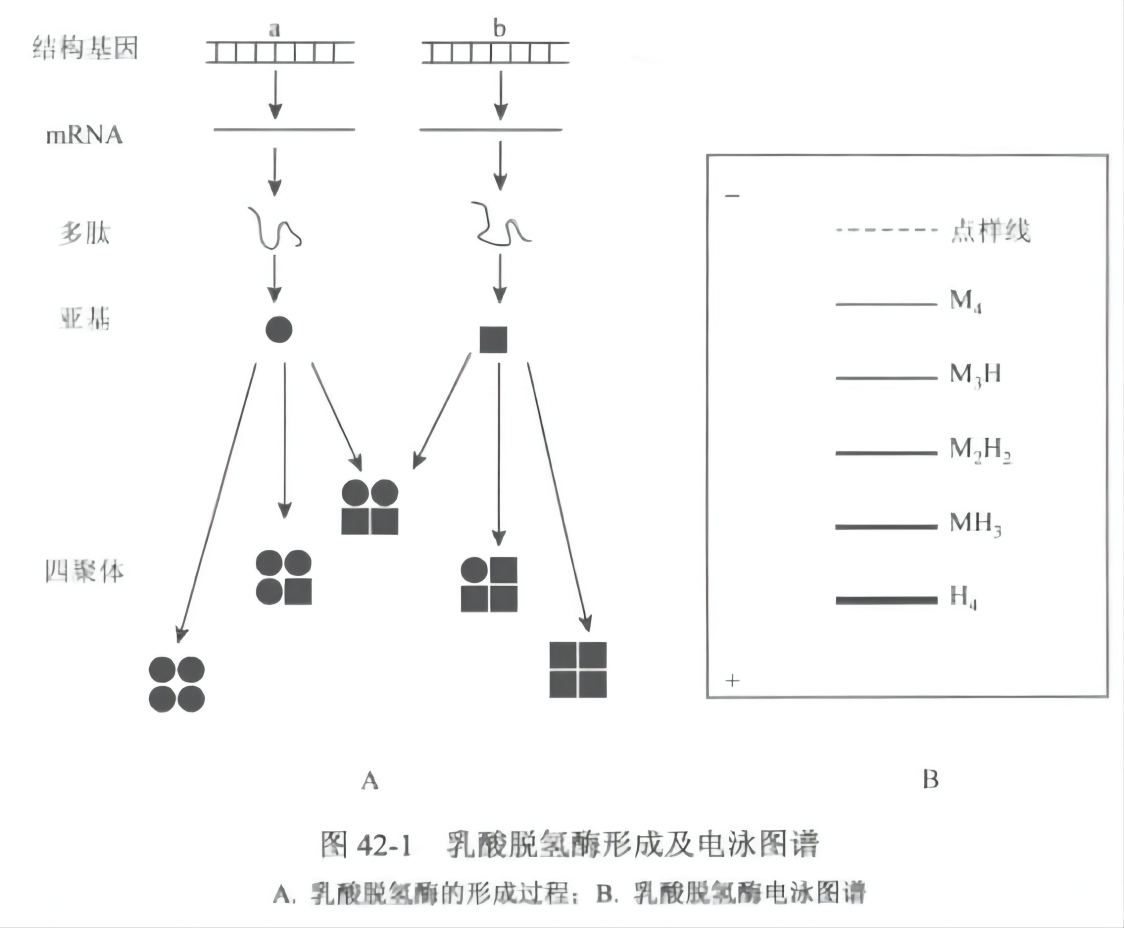
同工酶分离方法主要有电泳法、层析法、酶学法和免疫学法等,其中以电泳法应用最为广泛。其原理在于同工酶是功能相同但结构不同的一组酶,由于其结构中氨基酸序列或组成存在差异,从而使同工酶在电泳过程中,其迁移率也存在差异。乳酸脱氢酶(LDH)是研究的最多的同工酶。生物学功能:遗传的标志;和个体发育及组织分化密切相关;适应不同组织或不同细胞器在代谢上的不同需要,用电泳方法将 LDH 同工酶分离,分析其酶谱,发现脊椎动物各组织中有 5 条酶带。每条酶带的酶蛋白都是由 4 条肽链组成的四聚体,LDH 有两类肽链,A(M)或 B(H),各有不同的免疫性质,按排列组合可形成符合于电泳酶带数的 5 种同工酶。LDH1 及 LDH5 分别由纯粹的 4 条 B 链(B4)和 4 条 A 链(A4)形成,称为纯聚体;而 LDH2、LDH3 和 LDH4 都是由两类肽链杂交而成的,分别可写成 AB3、A2B2、A3B,称为杂交体(图 42-lB)。
带电颗粒了在电场作用下,向着与其电荷相反的电极方向移动的现象,称为电泳(electrophoresis,EP)。利用带电粒子在电场中移动速度不同而达到分离的技术称为电泳技术。常用的电泳有两种:聚丙烯酰胺凝胶电泳(PAGE)及琼脂糖凝胶电泳,其中聚丙烯酰胺凝胶电泳为垂直电场,琼脂糖凝胶电泳为水平电场。琼脂糖或聚丙烯酰胺凝胶电泳是分离、鉴定和纯化 DNA 片段的标准方法。琼脂糖凝胶电泳分子置于电场中以一定速度(迁移率)移向适当电极。迁移率同电场强度、电泳分子所携带的静电荷数成正比,还与介质的摩擦系数相关。一定电场强度下 DNA 分子的迁移率取决于核酸分子本身的大小和构型。琼脂糖凝胶分辨 DNA 片段的范围为 0.2~50 kb;聚丙烯酰胺凝胶分辨力为 1~1000 bp。浓度越高,孔隙越小,分辨能力越强。凝胶电泳中,加入溟化乙锭(简称 EB)染料对核酸分子染色之后,将电泳标本放置在紫外线下观察,便可以十分敏感且方便地检测出凝胶介质中 DNA 的谱带位置。
过氧化物酶广泛存在于植物体中,是活性较高的一种酶。它与呼吸作用、光合作用及生长素的氧化都有关系。在植物生长发育过程中它的活性不断发生变化。一般老化组织中活性较高,幼嫩组织中活性较弱。这是因为过氧化物酶能使组织中所含的某些碳水化合物转化成木质素,增加木质化程度,而且发现早衰减产的水稻根系中过氧化物酶的活性增加,因此过氧化物酶可作为组织老化的一种生理指标。此外,过氧化物同工酶在遗传育种中的重要作用也正在受到重视。
材料与仪器
步骤
同工酶标记的基本过程可分为如下几步:
(1)提取酶液:取蚕豆幼芽 2 个和黄豆幼芽 3 个分别置于研钵中,加入 1 mL 水研磨匀浆,然后将样品移至小离心管中离心(1000 r/min)15 min,取上清液,备用。
(2)聚丙烯酰胺凝胶系统的配制(16 mL):
A 液:1 mol/L 盐酸 48.0 mL,Tris 36.0 g,TEMED 0.23 mL 加水至 100 mL,pH8.3。B 液:丙烯酰胺 30.0 g,甲叉双丙烯酰胺 0.8 g 加水至 100 mL。C 液:过硫酸铉(用前配制)1.4%。配胶,A:B:C:H2O = 1:2:0.4:4.6(体积比),配胶后立即灌进装胶室,插上梳子。
(3)电极缓冲液配制:Tris 3.0 g,甘氨酸 14.4 g 加水至 1000 mL,pH8.8,使用时稀释 10 倍。
(4)染色液配制(过氧化物酶染液):乙酸联苯胺溶液 5 mL,3% H2O2 2 mL,H2O 93 mL。
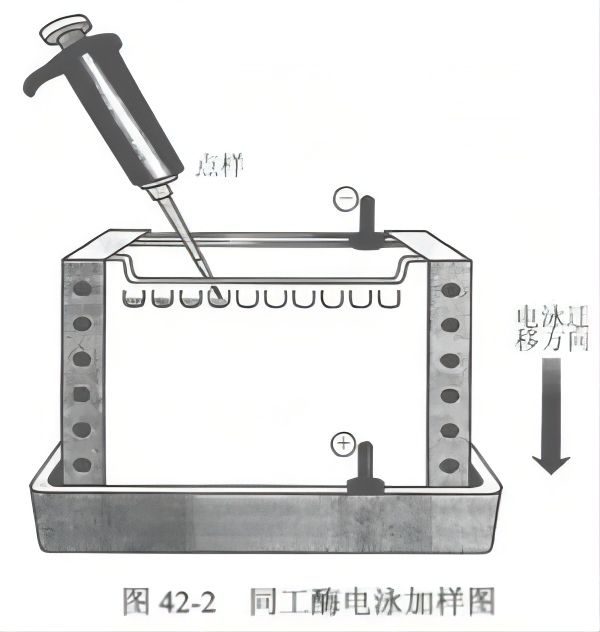
(5)加样和电泳:向各加样孔中滴加 24 μL 的样品酶粗提液。加 1 小微滴 1% 漠酚蓝,在电压 120 V 下进行电泳分离,根据指示剂位置确定电泳时间。电泳结束后,关掉电源,取出玻璃板,用刀片或薄板轻轻将玻璃夹层分开(图 42-2)。
(6)染色:将完整的胶块置于染色器皿中,加入染色液,浸泡整块凝胶,室温下染色 20~30 min,呈现酶带后取出胶块,用水漂洗以终止染色。
(7)对带型清楚的胶应做摄影记录或做扫描测定,胶晾干后做永久保存。
(8)根据迁移率 R 值绘制同工酶酶谱及聚类分析。① 计算酶谱的相似性系数:c = 2 w/(a + b)。 其中,c 表示同工酶谱的相似系数,a 为种 A 酶谱的酶带数,b 为种 B 酶谱的酶带数,w 为 A、B 两种的相同酶带数。② 计算不相似性系数值:d = L-c。 ③ 釆用未加权配群法,即 UPGMA 法,进行聚类分析,根据结果绘岀树系图。④ 计算 Xi 值:Xi =(L + Da - Db)/2L。把不相似值总计最大的种酶谱定为a,在 X 轴上标记为 0,Xi 为所求种酶沿 X 轴对种 A 酶谱的距离;。L为种 A 的 a 与 B 的 b 之间的不相似值, Da 为种 A 的 a 与所求种酶之间的不相似值;Db 为种 B 的 b 与所求种酶之间的不相似值。经过计算得到各酶谱在 X 坐标轴上的排序,通过在轴上距离的远近,可以推测各分类群之间的亲缘关系(薛俊杰等,2000;CherreauetaL,1999;邹春静等,2003)。
来源:丁香实验