简介
植物根系的活力是植物生长的重要生理指标之一。植物的根系是肥水的主要吸收器官,又是物质同化、转化和合成的器官,因此,根系的生长情况和活动直接影响植物个体的生长情况、营养水平和产量水平。本实验的目的是掌握 α-萘胺氧化法测定植物根系活力的原理和方法。
原理
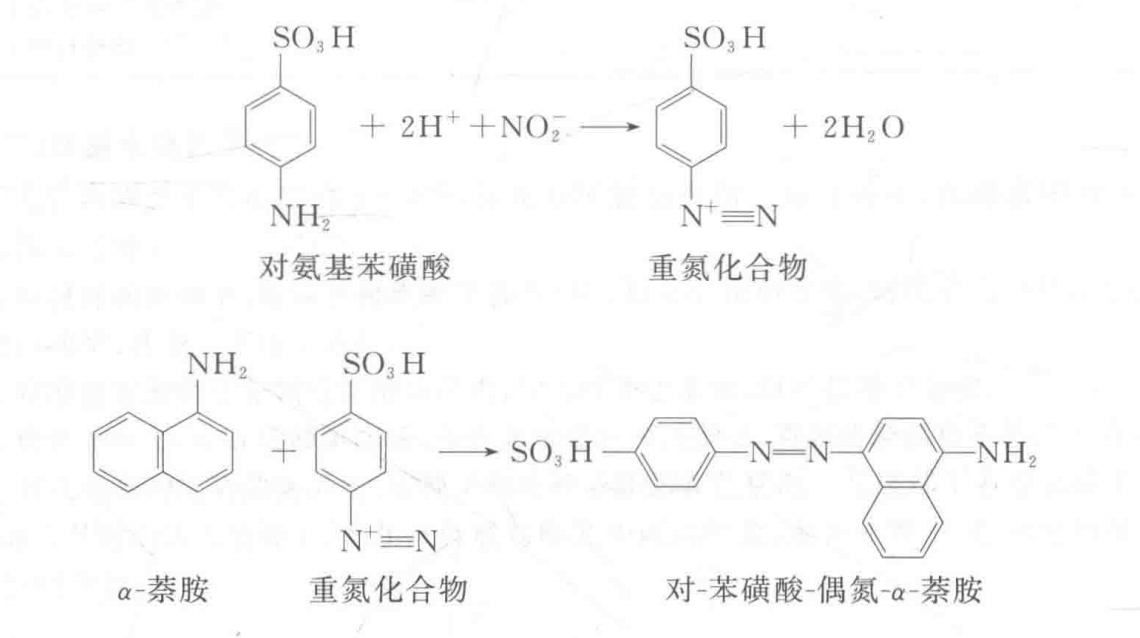
α-萘胺氧化法测定植物根系活力的基本原理是植物的根系能氧化吸附在根表面的 α-萘胺,生成红色的 α-羟基-1-萘胺,沉淀于有氧化力的根表面,使这部分根染成红色。根对 α-萘胺的氧化能力与其呼吸强度有着密切关系。所以,可以根据染色深浅定性地判断根的活力;也可以测定溶液中未被氧化的萘胺量,以确定根系活力的大小。α-荼胺在酸性环境中与对氨基苯磺酸(磺胺)和亚硝酸盐作用生成红色的偶氮染料,可供比色测定荼胺含量。其反应式如下:
材料与仪器
步骤
α-萘胺氧化法测定植物根系活力的基本过程可分为如下几步:
(一)定性观察
从田间挖取水稻植株,用水冲洗根部附着的泥土,洗净后再用滤纸吸去附着在水稻根上的水分。然后将植株根系浸入盛有 α-萘胺溶液的容器中(α-萘胺的浓度为 25 mg·L-1), 容器的外面用黑纸包裹,静置 24~26 h 后观察水稻根系着色状况。着色深者其根系活力较大,着色浅者其根系活力较小。
注意事项:注意记录 α-萘胺的氧化时间,α-萘胺溶液尽量现配现用。
(二)定量测绘
A. 绘制 α-萘胺标准曲线:取浓度为 50 mg·L-1 的 α-萘胺溶液,配制成浓度为 50、45、40、35、30、25、20、15、10、5 mg·L-1 的系列溶液,各取 2 mL 放入试管中,加蒸馏水 10 mL、1.0% 对氨基苯磺酸溶液 1 mL 和亚硝酸钠溶液 1 mL,在室温下放置 5 min,混合液即变成红色,再加蒸馏水定容至 25 mL,在 20~60 min 内进行比色,波长为 510 nm, 读取吸光度 A,然后以 A510 为纵坐标,α-萘胺浓度为横坐标,绘制标准曲线。
B. α-萘胺的氧化
挖出水稻植株,并用水洗净根系上的泥土,剪下它的根系,再用水洗,待洗净后用滤纸吸去根表面的水分。称取 1~2 g 根放在 100 mL 三角瓶中。然后加入 50 mg·L-1 的α-萘胺溶液与 0.1 mol·L-1 pH7.0 磷酸缓冲液各 25 mL,轻轻振荡,并用玻璃棒将根全部浸入溶液中,静置 10 min 后,吸取 2 mL 溶液,测定 α-萘胺含量[测定方法见下面(C)],作为试验开始时的数值。再将三角瓶加塞,放在 25 ℃ 恒温箱中,经一定时间后再进行测定。另外,还要用一只三角瓶置同样数量的溶液,但不放根,作为 α-萘胺自动氧化的空白,也同样测定,求它自动氧化量的数值。
C. α-萘胺含量的测定
吸取 2 mL 溶液,加入 10 mL 蒸馏水,再在其中加入 1% 对氨基苯磺酸溶液 1 mL 和亚硝酸钠溶液 1 mL,在室温中放置 5 min, 待混合液变成红色,再用蒸馏水定容到 25 mL。在 20~60 min 内进行比色,选用波长 510 nm, 读取光密度,查对标准曲线得相应的α-萘胺浓度。用试验开始(10 min)时的数值减去自动氧化的数值,即为溶液中所有的 α-萘胺量,再减去试验结束时的 α-萘胺量,即得试验期间为根系所氧化的 α-萘胺量。被氧化的 α-萘胺量以 μg·g-1·h-1 表示。
(三)实验结果
按下列公式计算 α-萘胺的氧化强度,求出根活力大小。
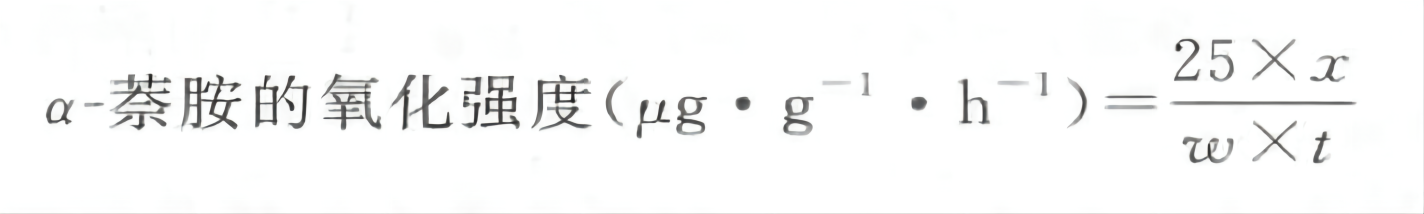
式中:x一氧化的 α-萘胺浓度,μg·mL-1;
25一样品中被还原的 α-蔡胺定容的量,mL;
ω—样品鲜重,g;
t一氧化的时间,h。
来源:丁香实验







