简介
掌握比色法测定过氧化物酶活性的原理及方法。
原理
过氧化物酶(POD)催化过氧化氢氧化酚类的反应,产物为醍类化合物,此化合物进一步缩合或与其他分子缩合,产生颜色较深的化合物。本实验以邻甲氧基苯酚(即愈创木酚)为过氧化物酶的底物,在此酶存在下,H2O2将邻甲氧基苯酚氧化成红棕色的4-邻甲氧基苯酚,该物质可用分光光度计在470 nm处测定其吸光值,即可求出该酶的活性。其反应为: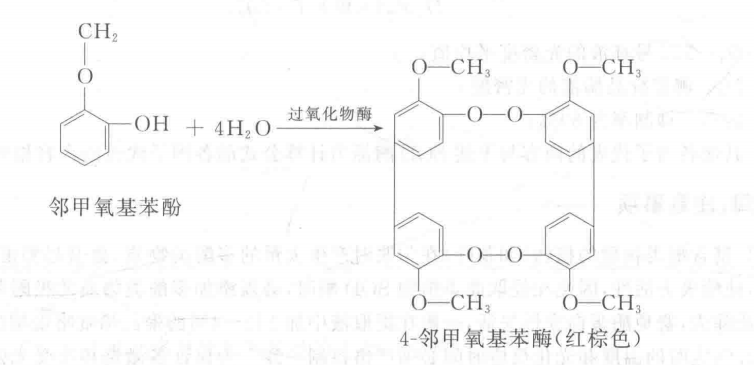
材料与仪器
步骤
过氧化氢酶(CAT)活性的测定的基本过程可分为如下几步:
1. 酶液提取:取不同水稻根系(根系表面水分吸干)1 g,剪碎置于研钵中,加5 mL 0.1 mol · L-1 Tris-HCl缓冲液(pH 8.5),研磨成匀浆,以4000 r・min-1离心5 min,倾出上清液,必要时残渣再用5 mL缓冲液提取一次,合并两次上清液,保存在冰箱(或冷处)备用。
2. 取光径1 cm比色杯2个在其中1个中加入反应混合液3 mL和磷酸缓冲液1 mL(或加热煮沸5 min的酶液),作为校零对照,另1个中加入反应混合液3 mL,上述酶液1 mL(如酶活性过高可稀释之),立即开启秒表记录时间,用分光光度计在波长470 nmT测量吸光度值, 每隔1 min(60 s)读数1次共测3 min。
3. 结果计算:以每分钟光密度变化(以每分钟人以A470为 0.01个活力单位)表示酶活性大小,即
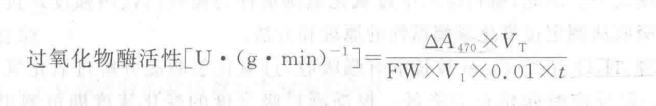
式中:A470—反应时间内吸光度的变化;
Vt一粗酶提取液总体积,mL;
V1一测定用粗酶液体积,mL;
FW—样品鲜重,g;
0.01—A470 每下降0.01为1个酶活单位,U;
t一反应时间,min。
注意事项
1. 酶的提取、纯化需在低温下进行。
2. H2O2要在反应开始前加,不能直接加入。
3 .酶促反应较快,计时应准确、快速。
来源:丁香实验






