简介
大鼠心脏缺血-再灌注损伤,是用来复制心脏缺血-再灌注损伤动物模型的实验方法。
原理
大鼠心脏缺血-再灌注损伤法的基本原理是通过结扎大鼠心脏冠状动脉左前降支阻断血供,而后解除结扎恢复血液灌流,观察大鼠心电图和心功能指标变化情况。
用途
大鼠心脏缺血-再灌注损伤法可用于观察再灌注过程中心功能的变化及再灌注性心律失常的表现。
材料与仪器
器材:
多功能生物信息采集仪(或多道生理记录仪)
小动物人工呼吸机,心电图机,小动物常规手术器械
小拉钩,电烧灼器及其配件,气管插管
左心室导管(直径0.5~0.8 mm的聚乙烯管)
充气硅胶管(直径3 mm、长2 cm),小圆针,6-0号线。
试剂:
①12% 水合氯醛溶液;
②稀肝素(125 U/mL);
步骤
大鼠心脏缺血-再灌注损伤法的基本过程可分为如下几步:
A. 动物称重后腹腔内注射12% 水合氯醛(0.3~0.4 mL/100 g)麻醉,仰卧固定于小动物手术台上。
B. 剪去颈前及胸部手术部位被毛,作一长约2.5 cm的颈前正中切口,分离气管并插入气管插管,接小动物人工呼吸机。
C. 分离右侧颈总动脉,结扎远心端,近心端用小动脉夹夹闭,在靠近结扎处剪口(朝向近心端成45°夹角剪开颈总动脉的1/3~1/2),插入左心室导管(预先充满稀肝素),用线轻扎固定后松开动脉夹,将导管缓慢插入左心室,双重结扎固定,并将导管另一端连接多功能生物信息采集仪(或多道生理记录仪)用于测定多项心功能指标,连接标准肢体II导联记录心电图。
D. 在胸骨左侧旁约0.5 cm处、第4肋间纵行切开皮肤与肌层,自切口处开胸后立即行呼气末正压呼吸,调整呼吸频率、吸呼比及潮气量(根据呼吸机使用指南及大鼠表现调节,参考值为呼吸频率60~70次/分,吸呼比1:2,潮气量为0.4~0.5 mL)。
E. 剪开心包暴露心脏,以左冠状静脉主干为标志(左冠状动脉主干和前降支始段大多与伴行静脉相伴行(静脉居左)或互相交叉),在左心耳根部下方2~3 mm处进针,用6-0线从左冠状动脉的左侧进针,在穿过左冠状动脉下方的心肌表层后在肺动脉圆锥旁出针(图9-1),结扎后左室壁变苍白,并出现室壁运动减弱。将心脏放回原位,待心电图恢复稳定10 min后描记正常心电图及LVP、LVEDP、士dp/dtmax等心功能指标。
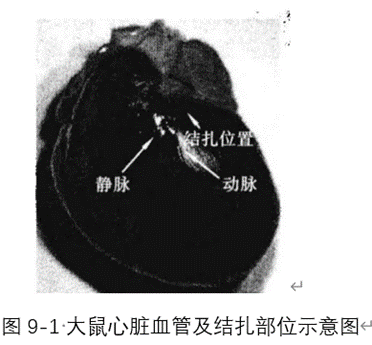
注意:假手术组,仅在冠状动脉左前降支(LAD)下穿线;单纯缺血组除不松解结扎线外,其余均与缺血-再灌组相同。
F. 结扎冠状动脉左前降支:静脉注入肝素100~200 U,结扎时将充气硅胶管置于结扎线与血管之间,利用充气硅胶管的弹性压迫使状动脉闭塞5~10 min。在冠状动脉闭塞期间,每隔2 min记录一次心电图和心功能指标。
G. 剪开结扎线解除闭塞,移去硅胶管,恢复血液灌流,继续观察30~60 min。记录解除结扎即刻及随后动态的心电图和心功能指标变化。
注意事项
(1)行左心室插管时要小心,防止出血,切勿刺破主动脉壁及心室壁;作冠状动脉穿线宜采用无创伤小圆缝合针,动作要轻,位置要准,且进针宜浅,否则易引起传导阻滞而导致动物死亡。
(2)有关潮气量的调整:①潮气量可以大鼠呼吸时胸廓的起伏程度作为参照,较麻醉状态下呼吸程度稍大即可;②观察大鼠心脏表面,左心室应该是鲜红色,如果暗红则应该加大潮气量;③如果潮气量过大,可以看到肺脏被气体撑得非常饱满,失去了原来的粉红色。
(3)严格掌握缺血时间,过长或过短均不易诱发再灌流性心律失常。
来源:丁香实验