简介
RNAi 是一种通过体内的剪切形成小的(大约 21 nt)双链 RNA,而其中的反义链与靶向基因的转录本互补,形成的双链结构介导持续的靶向基因的降解,从而使得靶向基因沉默。与基因敲除相比,RNAi 介导的基因沉默更加快速,节约高效,其广泛地被用于功能基因组的研究,也非常适应研究广泛生物的同源基因。
原理
基于 RNAi 的 knock-down 的技术原理是使用 Ⅱ 型启动子转录长的反向互补长片段,经过转录形成长的发卡结构转录本,经过细胞内的 RNA 加工形成双链的短的干扰 RNA;同样可以通过单个 Ⅱ 型启动子启动反向互补的目标 siRNA 序列形成一个发卡结构,最终经过剪切形成双链 siRNA;使用两个 Ⅱ 型启动子启动短的 RNA 退火形成双链短 RNA;以及表达 miRNA 在体内形成可 knock-down 的短单链 RNA。这些载体都最终形成 RISC,随后形成组织 mRNA 的剪切或降解,从而使得目标基因沉默。
材料与仪器
器材:
一次性无菌手套、手术钳、注射器、移液枪、枪头、PCR 仪、水浴锅、离心机、电泳仪;
材料:
小鼠、促性腺激素、DNA 聚合酶、限制性内切酶、连接酶、琼脂糖、电泳缓冲液。
步骤
一、RNA 干扰靶点的筛选
(一)查找 mRNA 序列或序列的登录号
(二)利用网上免费工具进行 RNAi 的靶序列设计
二、RNA 干扰载体的构建
(一)pSico 寡聚核苷酸的设计
根据第一部分提供的方法我们可以找到合适的 CD8 的靶向序列,以 19mer:GCTACAACTACTACATGAC 为例。那么正向引物可以设计为:5'-TGCTACAACTACTACATGACT-TCAAGAGAGTCATGTAGTAGTTGTAGCTTTTTTG 反向引物为:5'-GTTACAAAAAAGCTACAACTACTACAT-GACTCTCTTGAAGTCATGTAGTAGTTGTAGCA 这样就可以保证退火时 5' 为末端,3' 为 XhoI 酶切后的黏末端。
(二)克隆寡聚核苷酸到 pSico 载体
1.订购引物:订购引物时需要 5' 磷酸化,PAGE 纯化。用水稀释到 100 μmol/L。
2.退火
3.连接转化:按照酶切体系进行连接,室温孵育 3 小时后加入 2 μl 连接酶,随后进行细菌转化。
4.阳性克隆的酶切鉴定 使用 Sac II-Not I(pSico)或 Xho I-Xba I(pSicoR)双酶切进行阳性克隆鉴定。其中酶切出来的小片段阳性比空载大 50 bp(pSico 中空载为 660 而阳性的为 710;pSicoR 中空载为 350 阳性载体为 400 bp)。
5.测序验证 构建好的载体最好要进行测序以确认载体是否符合设计。测序时应注意此载体会形成发卡结构,请使用特殊的测序。
三、knock-down 干扰模型的建立
使用制作 shRNA 质粒载体,线性化后直接原核注射小鼠受精卵,操作方法与普通转基因小鼠的制备方法类似。
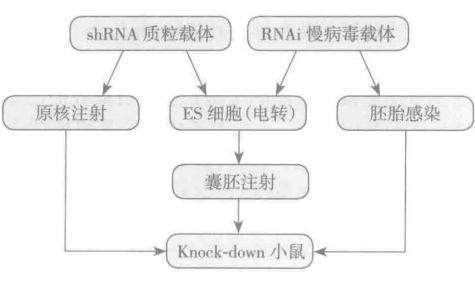
四、干扰效应的检测及表型分析
(一)检测小鼠体内的 mRNA 水平:在 mRNA 水平可以使用 Northern blot,qRT-PCR,原位杂交,大规模的甚至可以使用芯片技术检测目标基因的表达水平。
(二)使用 Western blot,IF,ELISA,FACS 等检验干扰的效果。
注意事项
RNAi 的作用是高度序列依赖的,虽然这些机制还没有完全弄清楚,但目前有一些原则可使得我们设计的 RNAi 高效。如下:
1、靶向基因的 cDNA 靶向区域必须位于起始密码子(ATG)下游 50~100 nt。
2、寻找 AA(N19)TT 或 r NA(N21),或 NAR(N17)YNN 的序列基序。其中 N 代表任何核苷酸,R 代表嘌呤(A,G),Y 代表嘧啶(C,U)。
3、避免靶向到内含子中,因为 RNAi 仅在细胞质中而不在细胞核工作。
4、避免序列的 G + C 含量大于 50%。
5、避免连续 4 个或更多的核苷酸重复。
6、即使 RNAi 靶向到非编码区能够成功诱导基因沉默,也要避免基因的非翻译区。除非你需要抑制内源靶基因的表达后再表达突变体或标签融合基因,使之与内源基因相区别而设计到非翻译区位点等。
来源:丁香实验