简介
免疫印迹法(immunoblotting)是对蛋白质混合溶液中目的蛋白进行定性的方法,也是对目的蛋白在不同细胞或者同一种细胞不同条件下的相对含量进行半定量的方法。印迹技术最初用于核酸分子检测,后来人们发现蛋白质在电泳分离之后也可以转移并固定于膜上,因此该方法也用于蛋白质的定性定量分析。相对应于分析 DNA 的 Southern 印迹和分析 RNA 的 Northern 印迹(见第六章),蛋白质印迹被称为 Western blotting。由于其利用的是抗原-抗体结合的方法检测目的蛋白质,故也被称为免疫印迹技术。
原理
免疫印迹法测定细胞分泌蛋白质含量的基本原理是蛋白质进行免疫印迹之前通过物理或化学的方法使待测样品中的所有蛋白质成分沉淀,一方面去除各种糖、脂质和离子成分的影响,保证电泳效果;另一方面浓缩蛋白质,避免出现假阴性结果。混合物经变性聚丙烯酰胺凝胶电泳按分子量大小进行分离后,在电场中蛋白质分子从凝胶转移到NC膜或其他膜上,各个蛋白质条带的相对位置保持不变。然后采用特异性抗体检测目的蛋白质的含量。免疫印迹技术的基本流程如图10-7所示。
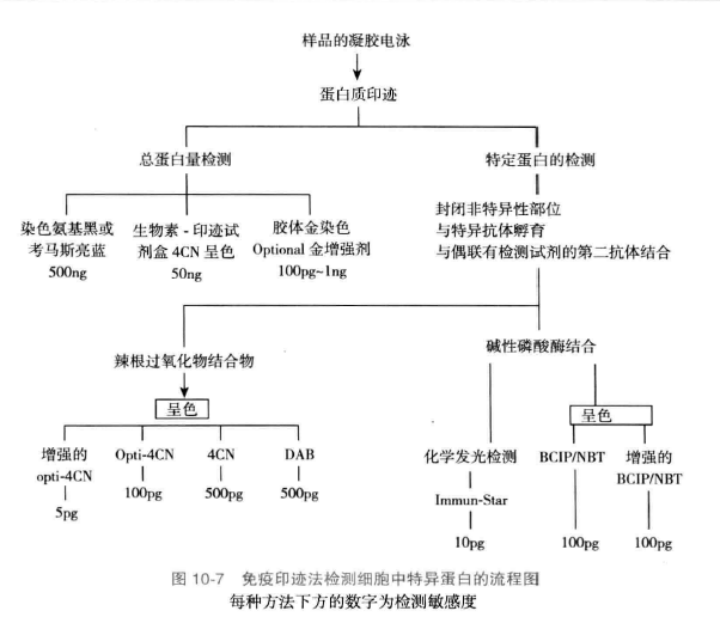
材料与仪器
步骤
免疫印迹法分析测定细胞分泌蛋白质含量基本过程与测定细胞可溶性蛋白相似,可分为如下几步,本方法以检测培养细胞内的色素上皮衍生因子(pigment epithelium-derived factor,PEDF)的表达状态为例说明免疫印迹检测技术的全过程。


B. 盐析沉淀或者低温有机溶剂沉淀法沉淀总蛋白,一方面去除各种糖、脂质和离子成分的影响,保证电泳效果;另一方面浓缩蛋白质,避免出现假阴性结果。利用硫酸按沉淀分离纯化蛋白的具体实验操作指导供参考。
硫酸按的加入有如下几种方法: CD 加入固体盐法:用于饱和度较高而不增大溶液体积的情况;
@)加入饱和溶液法: 用于要求饱和度不高而原来溶液体积不大的情况;
@透析平衡法:先将样品装于透析袋中,然后浸入饱和硫酸铁溶液中进行透析,透析袋内硫酸按饱和度逐渐提高,达到设定浓度后,目的蛋白析出。
D.细胞裂解物的 SDS-PAGE:制备 SDS-PAGE 胶。取出相当于 10~50μg 蛋白的细胞裂解上清液,用 1xSDS-PAGE 样品缓冲液对各个样品体积差进行补齐,保证所有样品上样的蛋白质总质量和体积一致,最后加入四分之一体积的 5xSDS-PAGE 样品缓冲液,95℃ 加热 3 分钟,快速离心使蒸发到管壁的水分沉到管底。每个样品取出 25μl 进行上样,同时在另外泳道内加入预染色的蛋白质分子量标准。在凝胶上加 8V/cm 电压,待指示剂溴酚蓝进入分离胶后将电压提高到 10V/cm,直至指示剂前沿到达胶的底部,关掉电源。
E.蛋白质的电转移:电转移是指在电场中蛋白质从凝胶转移到转移膜上的过程,目前主要有两种电转移模式,一种是湿法,一种是半干法。两种方法均使用滤纸和海绵将凝胶和膜夹在中间制成“三明治”结构进行电转印,其区别在于所使用电转移缓冲液的体积、是否需要预冷系统以及电转移时间等。这两种方法转移效率都较高,因此常根据实验习惯以及所用设备选择电转移方法。
目前常用的转移膜有 3 种,分别是硝酸纤维素膜(NC膜)、PVDF 膜以及尼龙膜,各种膜的特点见表 10-5。

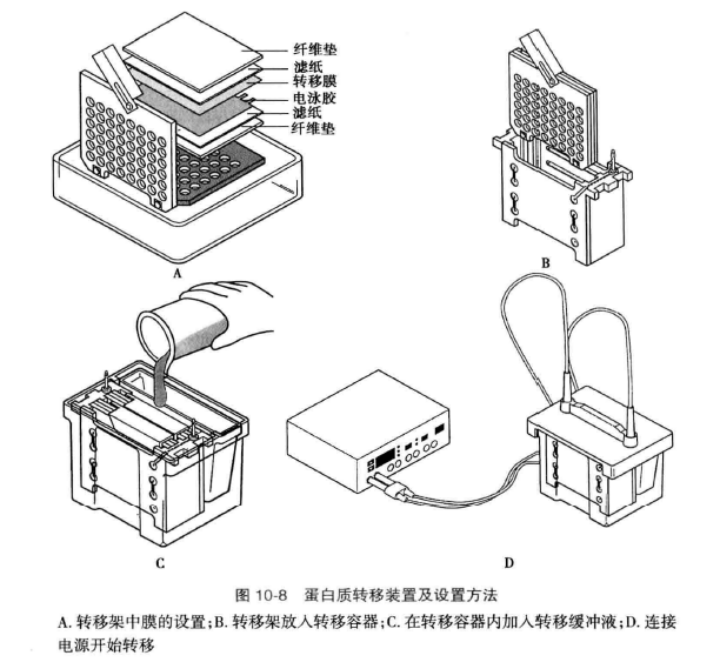


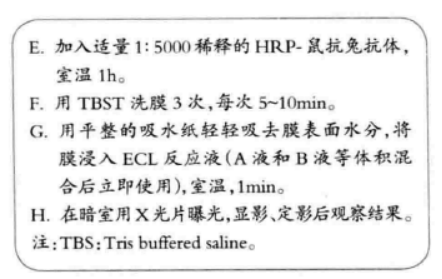
注意事项
免疫印迹法也可以用于分泌蛋白的定性定量分析,但是不能单独使用。原因是:
①血液以及细胞培养上清的成分复杂,常含有多糖或者脂类等成分,干扰 SDS-PAGE 电泳结果,导致蛋白质混合物不能按照分子量很好地分离,致使后续结果混乱;
②如果样品中蛋白质浓度较低,免疫印迹检测很可能出现假阴性结果。所以在进行免疫印迹之前通过物理或化学的方法使待测样品中的所有蛋白质成分沉淀,一方面去除各种糖、脂质和离子成分的影响,保证电泳效果;另一方面浓缩蛋白质,避免出现假阴性结果。
来源:丁香实验







