简介
免疫印迹法(immunoblotting)是对蛋白质混合溶液中目的蛋白进行定性的方法,也是对目的蛋白在不同细胞或者同一种细胞不同条件下的相对含量进行半定量的方法。印迹技术最初用于核酸分子检测,后来人们发现蛋白质在电泳分离之后也可以转移并固定于膜上,因此该方法也用于蛋白质的定性定量分析。相对应于分析 DNA 的 Southern 印迹和分析 RNA 的 Northern 印迹(见第六章),蛋白质印迹被称为 Western blotting。由于其利用的是抗原-抗体结合的方法检测目的蛋白质,故也被称为免疫印迹技术。
原理
免疫印迹法分析测定细胞可溶性蛋白质含量的原理和过程与 DNA 和 RNA 印迹技术类似。蛋白质混合物经变性聚丙烯酰胺凝胶电泳按分子量大小进行分离后,在电场中蛋白质分子从凝胶转移到 NC 膜或其他膜上,各个蛋白质条带的相对位置保持不变。然后采用特异性抗体检测目的蛋白质的含量。免疫印迹技术的基本流程如图 10-7 所示。

用途
免疫印迹技术主要用于检测样品中特定蛋白质的存在,并进行半定量分析。商品化抗体种类的大量增加以及一些特殊抗体的商品化扩大了免疫印迹技术的应用,例如多种抗磷酸化蛋白质抗体的发展使得用免疫印迹技术分析细胞信号转导过程中的蛋白质磷酸化变得十分容易。蛋白质印迹反应已经成为细胞信号转导研究中应用最广泛的技术。另外,蛋白质分子间的相互作用研究也依赖于免疫印迹技术。
材料与仪器
器材:离心机、离心管、蛋白质转移装置
试剂:
①5xSDS-PAGE 样品缓冲液
②电转移缓冲液
③蒸馏水
④去离子水
⑤含有 SDS 和巯基乙醇的缓冲液
⑥1% NP-40 裂解缓冲液: 1% NP-40, 50mmol/L Tris-HCl (pH 7 .4), 150mmol/L NaCl,0.1mmol/L PMSF, lμmol/L pepstatin,0.5mg/ ml leupeptin , 0.3μmol/L aprotinin 。
⑦溴酚蓝指示剂
⑧TBST (TBS(Tris buffered saline)/0.1 % Tween 20) 溶液
⑨ECL 反应液(A 液和 B 液等体积混合后立即使用)
步骤
免疫印迹法分析测定细胞可溶性蛋白质含量基本过程可分为如下几步,本方法以检测培养细胞内的色素上皮衍生因子(pigment epithelium-derived factor,PEDF)的表达状态为例说明免疫印迹检测技术的全过程。
A.细胞裂解物的制备:PEDF 位于细胞质,为检测细胞中PEDF的表达情况,需将细胞裂解(实验流程 10-3),释放细胞内容物,提取细胞的总可溶性蛋白。有多种裂解细胞的方法可供使用(表 10-3),可根据实验目的与实验条件进行选择。

在组织和细胞裂解过程中要特别注意蛋白质的降解问题。为此,可以在裂解缓冲液中加入多种蛋白酶抑制剂,并保持低温操作(表 10-4)。当采用 SDS-PAGE 样品缓冲液直接煮沸裂解时,由于操作时间很短和 SDS 对蛋白质(包括蛋白酶)的强烈变性作用,可以不用蛋白酶抑制剂。

B.细胞裂解物的蛋白定量:取 15μl 上清,利用前述的蛋白质定量微量法测定蛋白含量。如果浓度过高,可按比例稀释。
C.细胞裂解物的 SDS-PAGE:制备 SDS-PAGE 胶。取出相当于 10~50μg 蛋白的细胞裂解上清液,用 1xSDS-PAGE 样品缓冲液对各个样品体积差进行补齐,保证所有样品上样的蛋白质总质量和体积一致,最后加入四分之一体积的 5xSDS-PAGE 样品缓冲液,95℃ 加热 3min,快速离心使蒸发到管壁的水分沉到管底。每个样品取出 25μl 进行上样,同时在另外泳道内加入预染色的蛋白质分子量标准。在凝胶上加 8V/cm电压,待指示剂溴酚蓝进入分离胶后将电压提高到 10V/cm,直至指示剂前沿到达胶的底部,关掉电源。
D.蛋白质的电转移:电转移是指在电场中蛋白质从凝胶转移到转移膜上的过程,目前主要有两种电转移模式,一种是湿法,一种是半干法。两种方法均使用滤纸和海绵将凝胶和膜夹在中间制成“三明治”结构进行电转印,其区别在于所使用电转移缓冲液的体积、是否需要预冷系统以及电转移时间等。这两种方法转移效率都较高,因此常根据实验习惯以及所用设备选择电转移方法。
目前常用的转移膜有 3 种,分别是硝酸纤维素膜(NC 膜)、PVDF 膜以及尼龙膜,各种膜的特点见表 10-5。

电转移缓冲液(取Tris碱 3.03g、甘氨酸 14.41g、甲醇 200ml,加水至 1 000ml)需提前一天配制并保存于 4℃,蛋白质电泳完成以后,剥离凝胶并用蒸馏水短暂冲洗,将凝胶至于电转移缓冲液中平衡 10min,按照图 10-8 依次装好胶和转移膜。如使用 PVDF 膜,需先将膜浸入微量的 100%甲醇中数秒,直至整张膜变得半透明,用去离子水漂洗 PVDF 膜,放入电转移缓冲液中平衡 3~5min。NC膜直接浸润到电转移缓冲液中即可,浸泡大约 5min即可进行电转移。转移的时间与使用的电流有关,可以高电流快速在1h内完成转移,也可以在低电流下过夜。使用高电流时需要冷却转移装置。

E.目的蛋白的检测:在早期蛋白质印迹实验中,第二抗体主要使用 1251 标记,操作繁琐不便。20世纪90年代以后,人们改进了酶标第二抗体的检测技术,采用了更为敏感的底物显色、化学发光和荧光底物来显示目的蛋白的有无和所在位置,大大推动了蛋白质印迹技术的普遍应用(表 10-6)。
在上述方法中,综合敏感度和操作程序,较佳的方法是采用增强化学发光(enhancedchemiluminescence,ECL)的方法。ECL检测目的蛋 白的效果取决于目的蛋白丰度以及抗体的特异性、亲和力和效价。ECL法检测细胞裂解液中目的蛋白的主要步骤(实验流程10-4)包括:封闭(blocking)转移膜的非特异结合位点;目的蛋白与特异性抗体或称第一抗体(primary antibody)结合;特异抗体与抗抗体或称第二抗体(secondary antibody)结合;底物化学发光及显影。
在上述方法中,综合敏感度和操作程序,较佳的方法是采用增强化学发光(enhancedchemiluminescence,ECL)的方法。ECL检测目的蛋 白的效果取决于目的蛋白丰度以及抗体的特异性、亲和力和效价。ECL 法检测细胞裂解液中目的蛋白的主要步骤(实验流程 10-4)包括:封闭(blocking)转移膜的非特异结合位点;目的蛋白与特异性抗体或称第一抗体(primary antibody)结合;特异抗体与抗抗体或称第二抗体(secondary antibody)结合;底物化学发光及显影。

为比较不同样品的目的蛋白含量,可以将反应结果进行薄层扫描,比较各区带的峰面积;也可以在计算机扫描后,用相应软件计算不同区带信号的强弱。经一种抗体检测过的蛋白质转移膜要妥善保存。用含有 SDS 和巯基乙醇的缓冲液在 68℃ 洗涤转移膜 30min,可以去除已经结合的抗体,而原本转移到膜上的蛋白损失却很小,因此可以再次用于另一种目的蛋白的检测。
注意事项
注意事项:
1. 免疫印迹技术所测定的不是目的蛋白的绝对含量,而只能确定该目的蛋白存在与否及在可比条件下该蛋白的含量是高还是低。由于信号的强弱受多种因素的影响,所以一般仅作为半定量指标。不同目的蛋白由于所用的检测抗体不同,其含量也不具有可比性。
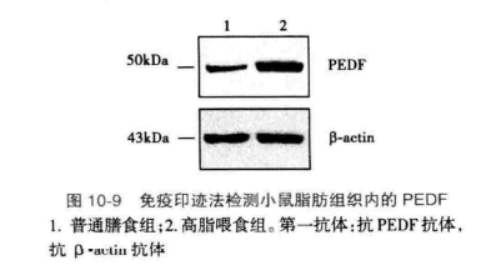
2. 比较一种目的蛋白在不同细胞或者同一细胞不同条件下的相对含量时,各样品的总蛋白量必须相同,只有这样所获结果才具有可比性。所以各个样品上样前要进行总蛋白浓度的测定,经过换算保证每个蛋白质样品的上样量一致是免疫印迹进行定量的前提。转移完成后,用可逆染色剂如丽春红 S 染色,确认转移是否完全以及不同样品间的蛋白质含量是否平衡。最后,使用一些细胞中管家基因表达的蛋白质,如肌动蛋白(β-actin)、微管蛋白(tublin)等作为内参照,对目的蛋白含量进行标准化(图 10-9)。
3. 蛋白质 SDS-PAGE 电泳的上样量不应过大。蛋白质上样量过大一方面导致蛋白质在电泳中分离效果降低;另一方面,如果超出了电转移膜的容量会导致最后获得的印迹信号降低。在过量蛋白质存在的条件下,蛋白质分子与膜的结合力较弱,而与后续抗体更容易结合,但是形成的抗原-抗体复合物很容易在实验过程中被洗脱下来。另外,为了达到较好的分离效果,应该选用适当浓度的凝胶进行 SDS-PAGE 电泳。
4. 开始电泳和转移前,一定要确认电极的正负极接头是否正确,以免损失样品。
5. 甲醇能够固定聚丙烯酰胺凝胶,并去除 SDS,同时提高蛋白质分子与膜的结合力,但是它能够降低大分子蛋白的移动效率。在电转移缓冲液中不加甲醇不会引起任何副反应,但是这种方法已被经验性地确定下来。目前也有许多甲醇含量较低或者不含甲醇的电转移缓冲液。另外,甲醇对非 SDS 凝胶或等电聚焦凝胶是不必要的。
6. 电转移时间由丙烯酰胺浓度、胶的厚度、凝胶的缓冲体系以及蛋白分子大小以及形状所决定。一般电转移时间太长,小分子量蛋白容易穿透转移膜而丢失;电转移时间过短,因大分子量蛋白质的转移效率有限,导致电转移效率降低,所以应该根据具体的实验设计选择不同孔径的转移膜以及电转移时间。
7. 碱性 pH 值和 SDS 更有利于蛋白质从凝胶上分离,但是酸性环境和甲醇则促进蛋白质同带负电荷的膜吸引。SDS 凝胶上的蛋白质分子因为带有 SDS 分子,导致其电转移速度快于非SDS凝胶。所以对于大分子蛋白质分子,向电转移缓冲液中加入适当 SDS(最大浓度为 0.1%)时,使蛋白质分子带负电荷,易于从凝胶洗脱,以提高电转移效率。
8. 在免疫检测中,要注意充分封闭非特异结合位点。目前较常用的是5%~10%的脱脂奶粉和牛血清白蛋白。
9. 如抗体反应在封口塑料袋内进行,一定要驱除袋内的所有气泡,否则会导致抗体结合不均匀,影响结果的正确性。
10. 操作始终要轻柔,接触胶和膜时都要戴手套,不要在转移膜上造成任何刮痕或磨痕(否则会造成背景信号)。在整个操作过程中,转移膜要始终在液体中,不能干燥。如果 PVDF 膜在使用过程中干燥,可以用甲醇重新湿润后使用。已经负载有蛋白质的转移膜以及已经干燥的 PVDF 膜也能够用甲醇重新湿润后进行目的蛋白检测。

来源:丁香实验