神经干细胞
最新修订时间:
材料与仪器
步骤
神经干细胞
大量研究表明发育和成熟的神经系统内均存在着神经干细胞 (neural s t e m cell,N S C )。发育过程中的胎脑的纹状体、海马、皮层脑室区等多个部分都含有大量的神经干细胞;而在成年哺乳动物体内的多个区域也同样可以分离出神经干细胞,如海马齿状回的颗粒下层、侧脑室的室管膜下区、大脑皮层、小脑和脊髓等。不同来源的神经干细胞的培养扩增的方法大致相同,故我们以胚胎大鼠神经干细胞的分离培养扩增方法为例。但值得注意的是,不同来源的神经干细胞对生长因子的反应性存在差异,所以可以对无血清限
定培养液中的细胞因子种类和浓度进行调整。
大鼠胎脑和胚胎脊髓神经干细胞的分离培养扩増
大 鼠 胎 脑 和 胚 胎 脊 髓 N S C 的 分 离 、培养
⑴ 仪 器 、材料和试剂:
洁净工作台;二氧化碳培养箱;电子分析天平;电热保温干燥箱;倒置显微镜;焚光显微镜;Milli-Q超纯水制备系统;调温低速离心机;孕鼠;手术器械;75% 乙醇;b F G F ;E G F ; D M E M /F 12(1 : 1) 培养基;胎牛血清; DNaseI; 多聚赖氨酸;胰蛋白酶;神经细胞培养添加剂B 27; D-Hank 缓冲液; P B S 缓冲液。
⑵ 将 怀 孕 13天 的 S-D 鼠用颈椎脱臼法处死,于 7 5 % 乙醇中浸泡消毒lOmin。
(3)无菌条件下剪开孕鼠腹部,取出胎鼠,放入预冷的 D -H a n k 缓冲液中浸洗2 次 。D -Hank: 氯 化 钾 0.4 g/L 、磷酸二氢钾0.06 g/L 、氯 化 钠 8.0 g/L 、碳 酸 氢 钠 0.35 g/L 、磷酸氢二钠 (Na2 H P O 4 • 7 H 20) 0.09 g/L 、酚红 0.02 g/L 。
⑷解剖显微镜下仔细分离胎脑及胚胎脊髓,分离的组织用D -H a n k 缓冲液冲洗后,小心去除表面的脑膜组织。
(5) 将分离的胎脑和胚胎脊髓组织剪成约I m m3 的碎块。
(6) 各 加 Iml P B S 和 Iml 0.25% 的胰蛋白酶,在 5 % C O 2 培养箱中3 7℃ 消 化 20 min。
(7) 加含血清的培养基以终止消化。
(8) 加5uL DNase I (15U /ul) 在 5 % C O 2 培养箱中 3 7 ℃ 消化 lOmin。
(9) 用吸管吹打成单细胞悬液,细胞计数, 1200r/m i n 离 心 5 min,弃上清。
(10) 把 细 胞 按 IxlO6 个/ml 的密度接种入N S C 培养液中,每日在显微镜下观察细胞的生长情况,注意培养基有无混浊和异物。隔日半量换液, 7〜 10天传代一次。
N S C 培养液 : D M E M /F 12、 b F G F 20ng/ml、 E G F 20ng/mI、 2 % B 27
悬 浮 培 养 的 N S C 的传代
(1)收集培养的神经球,离心 (1200r/min, 5 min)。
⑵ 弃 上 清 , Iml 的 I x P B S 重悬细胞,加 Iml 0.25% 胰 蛋 白 酶 。
(3) 37℃ 孵 育 IOmin, 将神经球消化成单细胞悬液,加含血清的培养基以终止消化
⑷ 视 N SC的量加入适量的 DNase I 消化细胞碎片, 37℃孵 育 5 min。
⑶ 离 心 ,弃 上 清 ,重悬细胞并计数,按 5x l〇5 〜 IxlO6 个/m l 的 比 例 加 人 N SC 培养 基 。
细 胞 单 克 隆 实 验
(1) 从原代培养形成的细胞克隆中选取单个细胞克隆,0.25% 胰酶消化后用巴氏吸管机械吹打使克隆分散成单个细胞。
⑵ 台 盼 蓝 染 色 计 数 后 ,将 细 胞 稀 释 为 IO2 个/ m l , 取 10^1加 入 到 9 6 孔 板 ,并补入NSC培 养 液 200ul。
(3) 24 h 后标记单细胞孔,继续培养。
⑷ 每 3〜 4 天添加半量N S C 培养液。
(5)单细胞克隆长大后用胰酶消化机械分离成单细胞悬液,将一个克隆的所有细胞种 人 T -25 c m 2 培养瓶中培养(培养基同前),待次代克隆长成后连续传代。
结 果 分 析
怀 孕 1 3 天胎鼠脑组织和脊髓组织分离培养的原代细胞在无血清培养基中生长少量细胞贴壁,培 养 2 天 后 ,有大量的细胞死亡,存活的细胞呈圆形,折光性强,部分 细 胞 分 裂 形 成 包 含 有 2 —— 4 个细胞的细胞团;第 3——5天 时 ,细胞团内细胞数目迅速增加,出 现 「神经球」样结 构 :细胞分裂(不完全排除细胞聚集)形成细胞团,呈 悬 浮 状 生 长 ,细胞无明显的突起形成。至 第 7——10天可生长成为由数百个甚至上千个细胞形成的细胞团(图4.19)。传代培养的 N S C 生长迅速,经 1 5 次传代培养图 4 .19 怀 孕 1 3 天 胚 胎 大 鼠 脑 组 织 来 源 的 神 经 球 后 细 胞 数 量 平 均 增 加 2 . 4 5x l 0 4 倍 ,细胞得到大量扩增。
神 经 干 细 胞 的 分 化
神 经 干 细 胞 的 自 然 分 化
⑴ 材 料 和 试 剂 :胎牛血清; D M E M /F 1 2 培养液; 4 % 多聚甲醛;小鼠抗-β微管蛋白(tubulin), 抗-巢蛋白 (nestin),抗-半乳糖脑苷脂(galactocerebroside, Galc)单克隆抗体;兔抗-GFAP单克隆抗体;各种荧光素标记二抗;免疫组化染色试剂盒; DAB或 AEC显色试剂盒。
(2) 取 传 至 第 3 代 、来源于同一个神经干细胞的亚细胞系克隆球,消化分离克隆制作单细胞悬液,按 IxlO6 个/m l 的比例种于预先放置多聚赖氨酸包被的盖玻片的6 孔培养板 中 ,并加入有血清培养基 (10% 胎牛血清的 D M E M /F 1 2 培养液),置 37℃ 、 5 % C O 2培养箱中培养 7 —— 1 0 天 。
(3) 观察细胞的自然分化状况、新形成的细胞形态,并用免疫细胞化学技术及细胞免疫荧光技术进行鉴定。原代和第3 代 N S C 神经球或单个细胞进行巢蛋白 (n e stin , N S 的特异标志蛋白)免疫细胞化学染色,第 3 代 N S C 在分化培养基中自然分化 7 —— 1 0 天后对巢蛋白、胶质纤维酸性蛋白(glial fibrillary acidic p rotein , G F A P , 星形胶质细胞的特异性标 志 蛋 白)、 β-微管蛋白(A tu b u lin ,神 经 元 的 特 异 性 标 志 蛋 白)和 半 乳 糖 脑苷(galactocerebroside, G a l C , 少突胶质细胞的特异性标志蛋白)进行染色, 在随机选取的10
个显微镜视野内对各种阳性细胞进行计数从而计算其比例,鉴 定 N S C 的自然分化能力。
具体步骤如下:
a.标 本 用 4 % 多聚甲醛固定2 0 m in 。
b.4% 多聚甲醛: 40g多聚甲醛溶解于70〇 ml PBS,加 热 到 60℃,不停搅拌,均匀溶 解 后 再 滴 入 lmol/L N a O H 1〜 2 滴至完全澄清,冷 却 后 补 充 P B S 液至总量1000 ml。放 代 冰 箱 备 用 。
c. IxPBS 冲洗, 5 minx3 次 。
d. 0.3% 过氧化氢室温孵育lOmin,以清除内源性过氧化物酶活性。
e . 蒸锻水冲洗, IxPBS浸 泡 5 min。
f. 0.3% TritonX-100 于 37°C温育 20 min, IxPBS 冲洗, 5 minx3 次。
g. 10% 的正常山羊血清封闭非特异性抗原,室温下孵育 10m in。
h. 倾去血清,勿洗,加一抗:抗-巢蛋白、抗 • 微 管蛋白、抗-GFAP、 抗-GalC。设立阴性对照:用不含一抗的抗体稀释液代替一抗工作液。 4℃过 夜 或 3 7 ℃孵育 2 h。
i. IxPBS 清洗, 5 minx3 次。
j.加链霉卵白素标记的二抗工作液30-400域荧光素标记二抗),3 7 ℃孵 育 30 min。
k. IxPBS 冲洗, 5 minx3 次 。
l. 加辣根过氧化物酶标记的生物素30——40ul(免疫荧光染色可直接进行荧光显微镜观察), 3 7 ℃孵 育 30 min。
m. IxPBS 冲洗, 5 minx3 次 。
n. DAB(或AEC)显色液显色,室 温 下 5——10 min, 光镜下观察显色深浅适度后终止染 色 ,自来水充分冲洗,脱水、透明及用中性树脂封片。
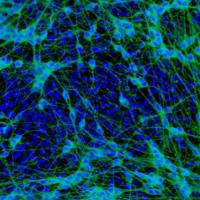
(4) 结 果 :本实验室的研究结果表明原代和第三代神经干细胞培养形成的「神经球 」样结构和消化后的单个细胞呈巢蛋白染色阳性(图4.20)。 神经干细胞在用含 10% 胎牛血清的DMEM/F 1 2 的分化培养基进行培养后,细 胞在 24 h 内即开始贴壁, 48 h 后细胞周围即可长出突起, 3〜 5天后突起逐渐增长,部分突起可相互联系。这些新形成的神经细胞具有不同的形态,其中可见到胞体呈圆形或椭圆形、核大、具 有 1 个 或 2 个突起的
神经元样细胞;也可见到有多个突起、胞核较小的星型胶质细胞。这些细胞包括分别呈G F A P 、 芦微管蛋 白 和 G a l C 染色阳性的细胞 (图4.21〜图4.23),胚胎脊髓来源的 N SC分化成的神经元、星型胶质细胞和少突胶质细胞的比例分别为 (15.8±8.3)%、(72.5±5.0)% 和
(3.6土2.5)%, 胎脑组织来源的N S C 分 化 成 这 3 种神经细胞的比例分别为(16.2土 7.5)%、(74.9±7.0)% 和 (4.8±3.4)%。

神 经 干 细 胞 向 多 巴 胺 能 神 经 元 分 化
研究人员探索了多种诱导神经干细胞向多巴胺能神经元分化的方案,如使用血清、维甲酸 (YanetaL 2001), 或降低氧浓度(Studer etal.2000),或添加神经营养因子、造血生长因子 (CarveyetaL 2001)、纹状体条件培养液等。各种条件诱导分化的多巴胺能神经元的比率、存活率、成熟度及分泌多巴胺的功能各有不同,因此很难评价哪种方案最优。故以我室研究的诱导方案为例,简述如下。
(1)材料和试剂:
神经干细胞, D M E M /F 12, B 27, E G F , b F G F ,抗大鼠多巴胺递质转运子 (dopaminetransportor, DAT)抗 体 ,抗大鼠酪氨酸轻化酶(tyrosine hydroxylase, TH)抗 体 ,抗坏血酸,IL-I,多聚赖氨酸。
⑵ 将 第 三 代 的 中 脑 N S C 消化成单细胞悬液,以 5xl04 个/m l 的密度接种于放置有多聚赖氨酸包被盖玻片的2 4 孔板内, Iml/孔 ,添加神经干细胞培养液贴壁培养2——3天。
(3) 2〜3天后,去除孔板内的旧培养液,添加诱导培养液: DMEM/F12 , 2 % B 2 7 ,抗坏血酸1〇〇umol1、 1L-1 110pg/ml。置 3 7 ℃ 、 5 % co2培 养 箱 中培养7 天。
抗坏血酸(ascorbic acid, IOOx): AA 0.0176 g 溶于 10 ml PBS 内,浓度为 0.01 mol/L。密闭分装, 4℃保存。
(4) 每 3 天半量换液,第 7 天时终止诱导
(5) 诱导分化效果检测:
a. 中 脑 N S C 在传代过程中D A 能神经细胞数量的变化:取原代细胞和传代培养的细胞,以 5xl04个/m l 接种于放置有多聚赖氨酸包被盖玻片的2 4 孔板内, Iml/孔 ,2〜 3 天贴壁后撤除生长刺激因子E G F 和 b F G F ,进行自发分化, 7 天后通过免疫细胞化学染色检测酪氨酸羟化酶的表达情况。
b. 取定向诱导分化的细胞进行多巴胺能神经元特异性的功能酶-酪氨酸羟化酶和多巴胺递质转运子的免疫细胞化学检测,步骤同前。
c. 高效液相色谱-电化学检测多巴胺的分泌量,取材及操作方法可参考文献报道(Park et al.2004, Serra et al.2000)
(6) 结 果 :免疫细胞化学检测发现只撤除生长因子而不加诱导剂的N S C 很少分化为T H 阳性细胞。抗坏血酸及IL-I 均有诱导中脑神经干细胞向多巴胺能神经元分化的作用,诱导分化后的部分细胞表达T H 及 D A T (图4.24)。
来源:丁香实验