为何我的 WB 压出的片子整张膜都发光?
我是金博士
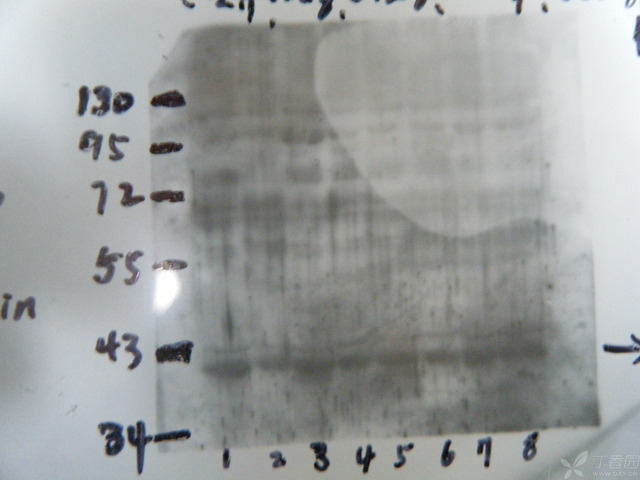
无论内参还是目的蛋白,压出的片子整张都发光。实验条件:从组织提的蛋白,分子量180kd,上样量40ug,70v,110v电泳,300mA两小时湿转,5%脱脂奶粉室温封闭2小时,santa一抗 1:500TBST稀释(推荐1:100-1:1000)4°C孵过夜,国产二抗1:2000TBST稀释(推荐1:2000-1:5000)室温2+小时。都是TBST洗膜undefined10min。发光剂是碧云天ECL PLUS。实验结果:几乎整张膜都发光,像盏黑夜里的明灯,指引我走向失败。
分享
8 个回答
monic
有帮助
一抗或二抗浓度太高都有可能引起曝光时胶片发白,在降低其浓度的情况下,还可以适当降低上样量或者底物不需要用plus的,用灵敏度较低的底物
qiuyuexp
有帮助
曝光过度,和封闭没有太大关系。降低一抗或二抗浓度、上样量、抗体孵育时间、改用效果不那么强的发光液或稀释发光液或把膜放到甲醇浸泡几秒(用镊子夹住膜在甲醇里涮2-3次)打断ECL和二抗链接,TBST多洗几次,再显色试试。
diudiu2006
有帮助
我上次做内源性蛋白也是一片白,可以考虑封闭的时间,我在4度封闭过夜,效果会好一些。同时考虑一抗和二抗的浓度,我个人观点,一抗的浓度会更重要一些,需要摸索浓度梯度,并且在一抗孵育后,PBST漂洗彻底。
五味子555
有帮助
可能是一抗或二抗浓度过高,一抗用1:500太高了,我都用1:1000,有时候还会有些背景,回收利用第二次的时候就没有背景了,二抗先试试1:5000吧,还有就是也要注意TBST的酸碱度,PH最好在7.0~8.0,偏碱了可能有背景,偏酸了也不好
weiran813
有帮助
其实主要是抗体特异性不好,跟封闭时间关系不大,封闭大于1h已足够。虽不知抗体效价如何,感觉一抗二抗浓度均较高,且二抗我一般孵育1小时,时间过长容易增加非特异结合。
雨飘冰
有帮助
我们的片子也出现过这样的情况,可能是:1、封闭不好,但可能性比较小,我们实验室是90分钟室温封闭,时间足够。2、二抗浓度和质量不好,建议首先调试一下二抗浓度,如果多种浓度下效果都不好,可以考虑换二抗,其实santa的二抗还是不错的,浓度比较好确定。
我是金博士
有帮助
1、转膜条件基本可以,一抗与二抗浓度均较高。建议:(1)先做二抗的稀释度(同时不同的ECL均需检测),用点杂交,用1倍TBS或PBS稀释二抗做不同的梯度,比如1:1000,1:2000,1:4000,稀释好后各取1ul点在NC膜上,RT干燥,加发光液,曝光,确定二抗的合适稀释度。二抗浓度高了HRP会把ECL中的底物消耗掉,在你加上ECL的时候会很亮,但是很快就会减弱了,首先要保证二抗的稀释度合适才行,才能保证压片时的效果。(2)下一步做一抗的稀释度,一抗也可以做几个不同的稀释度来摸条件,转膜后把膜剪成小条,加不同的稀释度的一抗,孵育进行后续步骤。2、内参做成这样,说明操作上不是很严谨,或者说是整个步骤有问题。3、WB过程是要避免膜干燥的,还有就是在ECL孵育的过程中要避免金属等污染膜,会抑制HRP的活性。
丁香通官方号
有帮助
我认为主要原因在于二抗的处理上。首先是浓度过高,导致结合于一抗的二抗过多,造成加入发光底物后条带处底物消耗过快,出现所谓的“反白”。其次,二抗孵育过后洗涤强度或者时间不够,或者最有可能是由于洗膜之后直接发光,导致整个膜都非特异性的均匀结合上了二抗,这个也更加促进了发光底物的耗竭。建议稀释二抗并加强膜的洗涤,祝你获得理想的结果!
相关产品推荐
提问
扫一扫

实验小助手

扫码领资料
反馈
TOP
打开小程序