长时间停止使用重启显微镜的 4 个步骤(故障排除)
Evident
实验室关闭、计划休假或突发紧急情况都可能会让您放下手头的研究。
以下是重返实验室启动和展开试验的四步指南
1. 为设备接通电源
以错误的方式为设备接通电源可能会对系统性能造成负面影响。以下为需要遵循的一些通用准则:
- 首先启动 PC 计算机:
- 打开系统所有硬件:根据系统情况不同,可能需要特别注意打开硬件的顺序。比如说,在打开触控屏 TPC 之前必须先接通奥林巴斯系统控制器 CBH 电源。有关具体说明,请参阅手册。
- 启动软件:如果在软件启动过程中遇到错误,请与产品技术人员咨询。
2. 准备成像
设备接通电源后,需要花一些时间适当准备、放置和调平样品才能进行成像。
准备样品
首先,选择适当的盖玻片。盖玻片应为 1.5 或 0.17 毫米厚(170 微米)。配合盖玻片使用的奥林巴斯物镜需要合适的厚度才能获得良好的图像质量。如果盖玻片太厚或太薄,可能会出现光学伪影。
务必检查盖玻片的厚度,并使用标准载玻片。某些应用可以使用塑料载玻片。但对于荧光成像而言,塑料具有自发荧光特性。它会在蓝色和绿色通道(有时在红色通道)中产生明显的背景。
另外在成像之前清洁盖玻片和载玻片也非常重要。比较好用的清洁溶液为蒸馏水稀释的 70% 乙醇。另外也可以选择光学清洁剂,比如 A.J.Funk and Co. 的 Sparkle Optical Lens Cleaner。
在清洁光学器件时,始终要使用擦镜纸。面巾纸或实验室纸巾具有磨蚀性,可能会损坏光学部件表面。
加载样品
接下来,以正确的朝向在显微镜上放置准备好的样品。在正置显微镜上盖玻片始终要朝上,在倒置显微镜上则要朝下放置。
使用倒置显微镜时,一定要检查样品是否密封良好。如果样品密封性不佳,那么液体可能会接触到物镜或物镜转换器。这类液体可能会腐蚀或氧化光学涂层、光学胶或显微镜硬件和电子器件的其他部分。
放置样品时,请注意物镜的工作距离。简单说,工作距离就是物镜在聚焦时需要靠近标本的距离。工作距离的范围从略大于 100 微米到数毫米不等。
通过参阅在线物镜目录,可以查看物镜的工作距离和刻在物镜外壳上的参数。

图 1.倒置显微镜需要将载玻片朝下放置。常见的错误是在放载玻片时将盖玻片朝上放置在倒置显微镜上,这样会导致图像模糊。始终要检查光学表面是否清洁,并且清洁这类表面时要使用擦镜纸
调平样品
大多数情况下研究人员一般不需要担心样品的平整度问题。
但是对于共聚焦显微镜、TIRF或图像拼接等更为敏感的应用而言,样品的平整度至关重要。当样品发生倾斜时,就可能会产生阴影。在将图像拼接在一起或者根据其在图像上的位置不同存在光线强度变化时,阴影就可能会导致伪影。
一种方法是通过某些载物台插入配件上的校平螺钉来改善样品的平整度。校平螺钉通常位于载物台插入配件的角上。样品倾斜比较的原因往往是校平螺钉没有对正。如果担心载物台插入配件造成样品倾斜,那么比较合理的办法是将这些螺钉完全旋出。
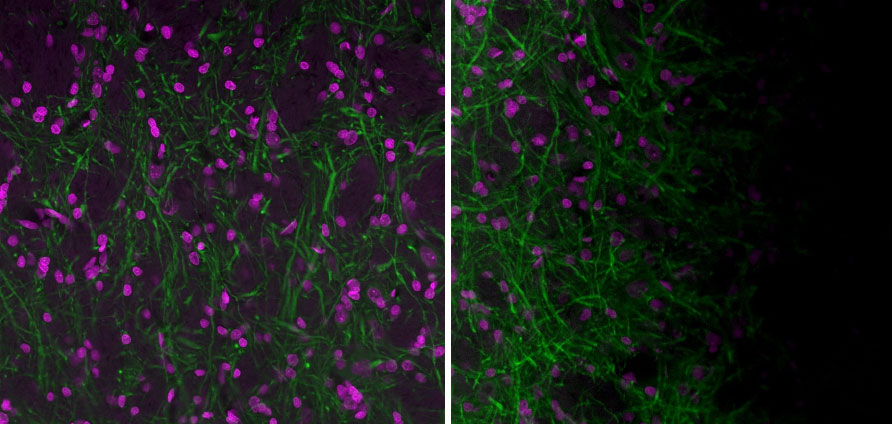
图 2.左图:使用经过良好对准的奥林巴斯 FV3000 激光扫描共聚焦显微镜和平坦样品采集的图像。右图:使用经过良好对准的 FV3000 显微镜以及不平坦样品所采集的图像。阴影的来源有些时候很难确定。通常情况下,样品在样品托架内不平整就可能会造成阴影。使用 20X UPlanXApo 物镜采集的图像。洋红色为Hoechst,绿色为 MAP2(MCA-5H11)经 Alexa 488 染色。
确定浸没介质
奥林巴斯提供五种主要的物镜类型:空气、水浸、无盖片水浸、标准油浸和硅油浸。
如果物镜所使用的浸没介质选择错误,图像质量就会受到影响。此外,如果浸油进入到并非为油浸设计的物镜某些部分内,就可能会造成设备损坏。
由于这些方面的原因,了解为物镜设计的浸没介质非常关键。物镜上的颜色标记可以轻松识别相应的浸没介质,确保研究者选择正确。
另外,还需要考虑工作流程。硅油和水的混合不会获得清晰的图像。此外,在水浸之前,需要将载玻片取出并进行清洁。
最后,务必要使用物镜制造商为光学器件而设计的油。

图 3.标准浸油或F型浸油(左)和硅浸没油(右)
3. 采集图像
准备好样品,就可以继续进行图像采集步骤了。以下为一些图像采集的有用技巧:
采集图像的最佳做法:
通过共聚焦或宽视场荧光显微镜采集图像时,通常首选使用较低的照度和较高的检测灵敏度或增益,可以减少导致光漂白和生物学变化的有害激光或弧光灯辐照 。
某些离子通道和凋亡途径可能会被激发光激活。但是,必须使用足够的照度才能获得足够质量的图像。高照度可以产生绚丽的图像。需要考虑的是该如何平衡激发光和检测光以及最终的实验目标。
校正环:
某些物镜配有校正环。在没有经过正确培训的情况下,这些功能可能会令人困惑。一般性指导原则包括:
- 无盖玻片时,请使用 0;而对于#1.5 盖玻片,则请使用 0.17。
- 检查校正环上是否标有温度提示。根据室温或 37°C(98.6°F)的不同情况,某些物镜的标度有所不同。设置校正环,开始成像,在保持聚焦图像亮度的同时优化校正环。最后这一步需要耐心,并且要多加练习。如果无法优化,则第一步时应保持接近校正环的一般性标记 0.0 或 .17。

图 4. 三只 60X 物镜。60X UplanXApo 物镜(右)使用标准浸油,且没有校正环。60X UplanApo 油浸物镜(左)使用设为 0.17(#1.5 盖玻片)的校正环。60X UPlanSApo(中间)使用硅油浸没,并在 37oC(98.6°F)时将校正环设为 0.17(#1.5)。优化校正环位置对于获得清晰的图像至关重要。
聚光镜对准:
如果主要应用是荧光观察,那么常规显微镜操作期间可能不会使用聚光镜。在这种情况下,可使用聚光镜手柄将聚光镜移离样品。
如果想要进行明场、相衬或 DIC 成像,那么第一步通常就要确认聚光镜的校准位置。在明场模式下,对样品聚焦,然后关闭视场光圈以便可以看到视场光栏的像。这一过程在 10X 或 20X 倍率下最容易完成。
如果视场光栏的像并不清晰或没有居中,可通过进行科勒照明让聚光镜在高度和/或中心处对齐。若要查找有关通过科勒照明进行聚光镜对准的信息,可访问奥林巴斯在线显微镜资源中心。

图 5.聚光镜对准程序:(a)关闭视场光圈,(b)将视场光栏的像中心居中,(c)确认精确中心,让视场光栏的像内切到视场边缘,(d)然后让视场光栏的像外切。
文件大小:
显微镜文件可能会很大。但文件的大小可以通过某些方式缩减。比如,如果不需要数据,“以防万一”对一切进行成像的想法实际上会让问题变得更复杂。
利用所需要的分辨率、位深和视场对所需要的部位进行成像。由于文件大小超出必要的范围会给数据存储和数据处理带来不必要的负担,因此避免成像范围超过或者达不到需要。
保存文件:
要尽可能地马上保存文件。并将图像保存到多个位置。
使用U盘或外部硬盘驱动器时务必当心。避免造成病毒感染。
为了避免这类风险,在将外部存储驱动器连接到成像系统PC计算机之前先要对其进行病毒扫描。
文件格式:
奥林巴斯使用诸如 OIR、OIF、VSI 和 OIB 等专有文件格式。这些格式可以:
-
提供未经压缩的全分辨率图像
-
保留适用于奥林巴斯成像系统的文件架构
-
记录成像参数中的元数据
在安装适当插件的情况下,FIJI / ImageJ 可以打开这类奥林巴斯文件。建议尽可能以奥林巴斯文件格式保存图像,但有时也需要将文件导出为 TIFF、JPEG 2000 或其他格式。
注意导出文件选项或图像文件类型可能会造成图像压缩或分辨率降低。避免使用 JPEG 图像,原因是这种格式往往会导致图像被压缩,并且经常发生数据丢失。
4. 关闭系统
正确关闭系统与正确启动系统同样重要。以下为一些最佳做法:
使用后清洁显微镜系统
成像完成后,清理系统不仅是规范要求,而且还可以防止损坏硬件。
显微镜载物台或成像区域往往会存在载玻片指甲油或苛性清除剂。这些表面都需要进行清洁,尤其是存在可见液体或其他残留物的地方。在从一个使用者到另一使用者的切换过程中,诸如目镜、触摸面板控件和聚焦手柄之类通常需要接触的表面均为可能受到污染和感染的区域。
为了减少病毒传播,清洁这些表面非常重要。建议使用蘸着蒸馏水加 70% 乙醇的擦镜纸清洁触摸面板控件和目镜。为了防止乙醇损坏橡胶,务必要取下目镜周围的橡胶眼罩。另外也推荐使用蒸馏水加 70% 乙醇和 Kimwipes 擦拭纸或纸巾清洁载物台表面或工作台。
指导原则就是让显微镜系统的状态比您一开始使用的时候更好。成像后从显微镜区域取出所有样品。大多数样品最好保存在 37°C(98.6°F)、室温、4oC(39.2°F)、-20oC(-4°F)或-80oC(-112°F)条件下。大多数载玻片或培养皿为了避免破裂需要进行保存,且要避光。有些样品必须要返回细胞培养箱中。
关闭显微镜系统电源
正确关闭系统有助于确保:
- 硬件的正确维护
- 让系统随时可供下一用户使用
在关闭系统之前,留意下一位使用者将会何时使用。如果马上就要使用系统,可以注销用户,同时保持所有硬件继续运行。但如果一个小时或更长时间内不会使用,建议将系统关闭。这样可以减少激光器、灯泡、风扇等需要根据工作时间进行更换和维修组件的使用时间。
关闭硬件之前,务必先要退出软件。退出软件之前就关闭显微镜控制盒可能会导致发生错误,并给下一位使用者带来潜在问题。
重返实验室的快速故障排除指南
以下为显微镜技术人员重返实验室时可能遇到的常见问题以及解决方法:
问题1 :图像看起来有点模糊。即使对图像聚焦,但似乎看上去也不清晰。
建议:使用擦镜纸蘸上蒸馏水加 70% 乙醇清洁物镜、盖玻片和目镜。确保所使用的是#1.5 盖玻片。最后检查一下物镜使用的浸没介质是否正确。
问题2 :更换物镜时就会完全失焦。
建议:检查 TPC 或软件中是否设置了齐焦校正。确认物镜是否已经完全旋入。检查物镜的浸没要求。其中包括检查是否使用了正确的浸没介质,并且没有与其他介质发生混合。从低倍率更换到高倍率时,需要调焦是正常现象。但当从高倍率变换到低倍率时失焦可能代表存在齐焦问题。
问题3 :查看荧光图像时,图像的一侧较亮,而另一侧较暗。
建议:首先,通过在 XY 平移载物台或样品检查一侧是否仍然存在这种一侧较亮另一侧较暗的情况。如果仍然存在这种情况,那么可能是因为样品不平坦。如果样品看起来很平坦,那么可能是激光或弧光灯没有对准。如果怀疑问题出在激光或弧光灯上,那么在尝试对准荧光激发光路之前当地的销售代表或奥林巴斯技术支持中心联系。
问题4 :使用其他软件打开图像时,图像看起来似乎不如在奥林巴斯软件中打开时那样好。
建议:可以在其他计算机安装的奥林巴斯软件上打开文件吗?奥林巴斯软件解决方案是保留分辨率或元数据信息的最简单方法。如果分析软件需要使用 TIFF 或其他通用文件格式,请使用原始全分辨率TIFF文件。除非使用成像软件打开,否则这类原始TIFF文件通常显示为黑色。另外在对图像进行缩放时,某些奥林巴斯软件也会进行插值。并非所有软件在进行缩放时均会对像素进行插值。有时这样会让图像在奥林巴斯软件中打开时看起来与 FIJI / ImageJ 不一样。
问题5 :我在实验室很多年一直使用#1 盖玻片,并且实验室这种情况很多。更换为#1.5 盖玻片对我们的重要性有多大?
建议:除非是水浸物镜,否则奥林巴斯物镜都是特别为#1.5 盖玻片设计的。如果物镜和标本之间没有足够厚的玻璃,就会出现光学伪影。重要程度取决于实验和成像要求。但不管怎样,您的图像分辨率达不到最好,并且成像质量也非最佳。我们建议尽快更换为#1.5 盖玻片。