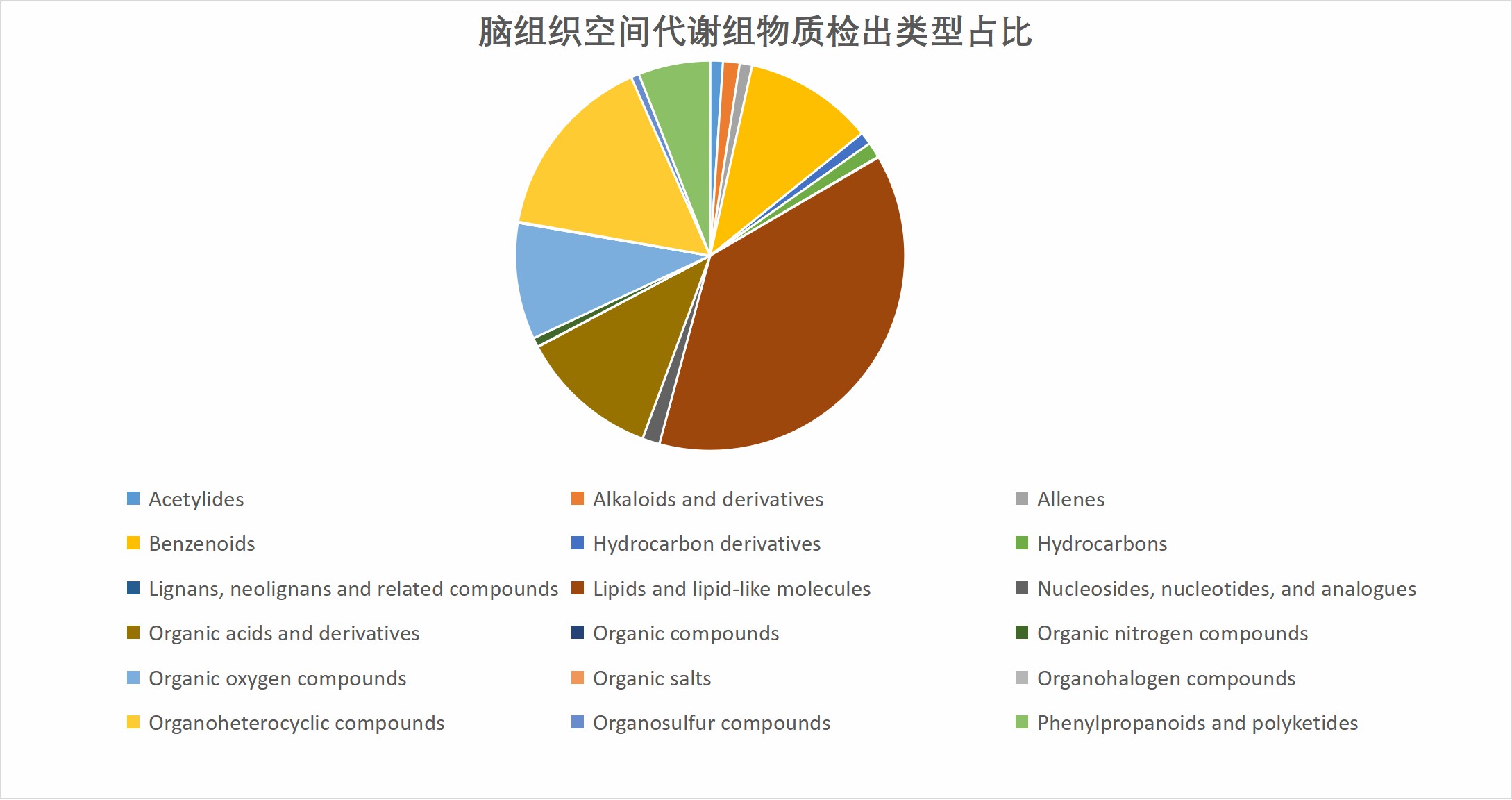
PNAS | 空间分辨代谢组学方法揭示“下游代谢物与上游代谢酶关联”的癌症相关代谢变化
鹿明生物
肿瘤代谢的表征能够为癌症病理机制研究、肿瘤诊疗新指标和干预靶点的发现提供新的契机。然而,到目前为止,如何全面的发现肿瘤的异常代谢,尤其是如何从代谢物和代谢酶两个层面上原位地表征肿瘤的异常代谢仍然面临非常大的困难。
中国医学科学院药物研究所天然药物活性物质与功能国家重点实验室再帕尔 · 阿不力孜科研团队在《PNAS》期刊发表的题为“Spatially resolved metabolomics to discover tumor-associated metabolic alterations”的研究论文,采用 AFADESI-MSI 技术,建立了空间分辨的原位代谢组学方法,并提出一种“下游代谢物与上游代谢酶关联” 的研究策略来表征肿瘤代谢改变;结合免疫组化分析验证,从代谢物和代谢酶两个层次和组织原位深入探究食管癌的代谢改变,发现并可视化表征了食管癌异常的代谢通路及其代谢酶。

实验设计:
收集 256 例人鳞片状食管癌(ESCC)组织标本,包括癌组织、癌旁组织和远端非癌组织,制成冰冻组织切片。如图 1 所示,采用空气动力辅助解吸电喷雾离子化质谱成像技术(AFADESI-MSI),采集上述组织中内源性代谢物及其空间分布信息;对相邻切片进行 HE 染色;采用 MassImager 质谱成像数据处理软件,使质谱成像图与 HE 染色图匹配重合,按不同组织类型及空间分布提取代谢物轮廓信息;使用 SIMCA 软件进行多变量统计分析,筛选出与肿瘤代谢相关的差异代谢物;根据差异代谢物及其鉴定结果富集分析发生变化的代谢通路及推测关键代谢酶;采用免疫组化方法检测锁定的代谢酶表达,进一步验证其与代谢标志物是否具有同样的空间分布特征。
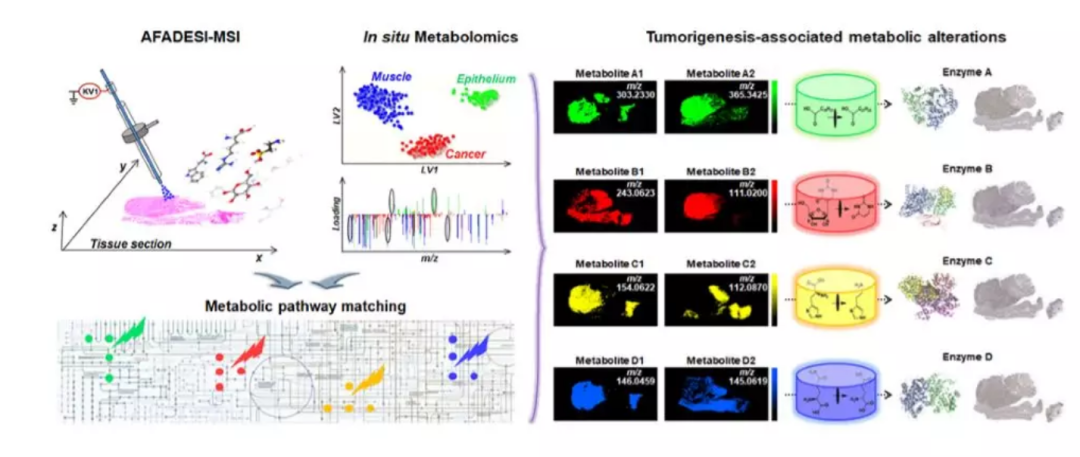
图 1 | 采用空间分辨的原位代谢组学研究策略,发现肿瘤代谢变化
研究结果:
1.脯氨酸生物合成上调
脯氨酸作为细胞微环境中的重要氨基酸参与细胞凋亡和自噬,在癌症代谢中的重要作用得到越来越多的关注。根据 256 个食管癌组织样本的统计数据,癌区脯氨酸离子强度显著高于上皮和肌肉区(P<0.001,图 2C)。采用免疫组化方法检测与脯氨酸合成相关的关键代谢酶吡咯-5-羧酸还原酶 2(PYCR2)在 ESCC 组织切片中的空间表达,发现 PYCR2 只在癌区表达(图 2e),与食管癌组织中脯氨酸的空间分布一致。
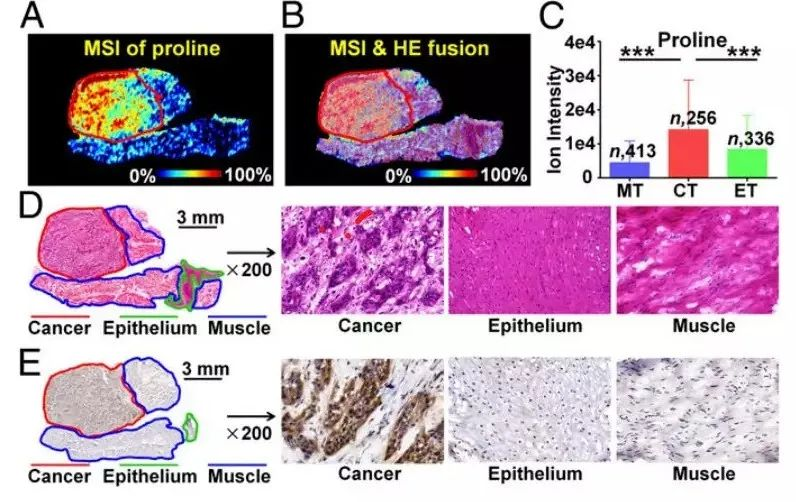
图 2 | 脯氨酸生物合成途径中关键代谢物和代谢酶的原位分析
(A)脯氨酸的质谱成像(B)光学-MSI 重叠图像(C) 256 例鳞片状食管癌(ESCC)患者癌组织和相邻上皮、肌肉组织中脯氨酸水平 **p~8lt~J0.001(D)ESCC 组织的 HE 染色图 (E)不同 ESCC 组织中 PYCR2 的表达 CT,癌组织;ET,上皮组织;MT,肌肉组织
2.尿苷代谢上调
尿苷是 RNA 合成的重要核苷前体,也参与嘌呤核苷酸生物合成和碳水化合物代谢。此外,组织中尿苷的水平对于嘧啶类抗代谢药物的抗肿瘤治疗至关重要。研究发现癌组织中尿苷含量高于上皮组织而低于肌肉组织(P<0.001,图 3 A1和A3),而尿嘧啶的含量在癌组织中显著升高(P<0.001,图 3 A2和A4),尿嘧啶/尿苷离子强度比(图 3 A6)在癌区显著增加,可以作为区分癌组织与癌旁正常组织的生物标志物。同样,免疫组化结果显示催化尿嘧啶生成尿苷的代谢酶尿苷磷酸化酶 1(UPase 1)在癌组织中的表达上调。
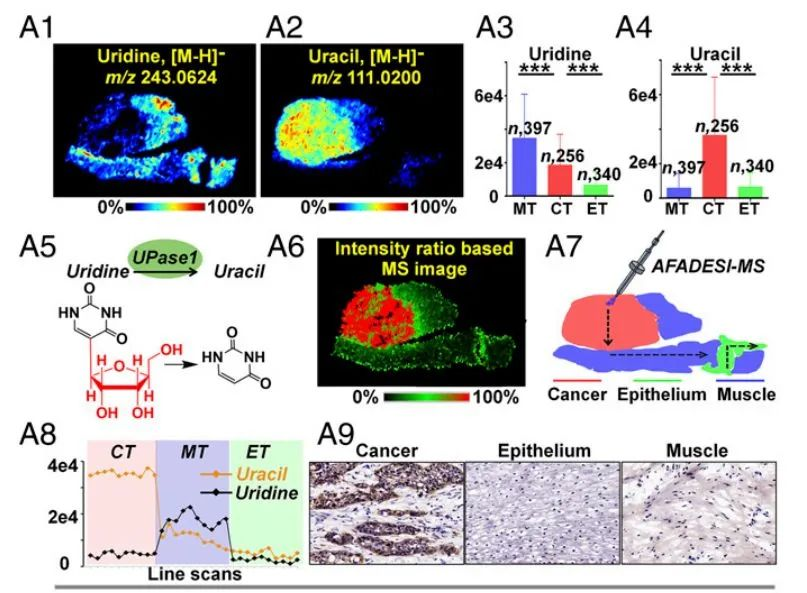
图 3A | 尿苷代谢途径中关键代谢物和代谢酶的原位分析
(A1,A2)尿苷和尿嘧啶的质谱成像图 (A3,A4)256 例鳞片状食管癌(ESCC)患者癌组织和相邻上皮、肌肉组织中尿苷和尿嘧啶水平 **p~8lt~J0.001(A5)UPase 1 介导的尿苷转换为尿嘧啶的代谢过程(A6)根据尿嘧啶/尿苷离子强度比值构建的质谱成像图 (A7)癌组织和相邻上皮、肌肉组织中尿苷和尿嘧啶的强度变化(A8)ESCC 不同区域 UPase 1 的表达 CT,癌组织;ET,上皮组织;MT,肌肉组织
3.组胺代谢下调
组氨酸在组氨酸脱羧酶(HDC)的介导下代谢为组胺。有越来越多的证据显示组胺直接参与致癌作用,可以作为一种潜在的细胞保护剂来改善癌症治疗。根据一些研究者的说法,基于组胺的治疗能促进癌细胞中 DNA 损伤、凋亡和衰老并可以显著增加患癌动物的存活率。在本研究中,组氨酸和组胺呈现完全相反的空间分布。根据 256 例食管癌组织样本的成像数据,组氨酸在癌组织中显著上调而组胺显著下调。组胺与组氨酸的离子强度差异如图3B7所示。通过计算组胺与组氨酸的离子强度比,对HDC介导的组氨酸脱羧反应进行了研究(图3B6),发现肿瘤组织的脱羧率相对于肌肉和上皮组织较弱。和基于强度比的质谱成像预测的一致,肿瘤组织的 HDC 表达水平低于肌肉组织和上皮组织。
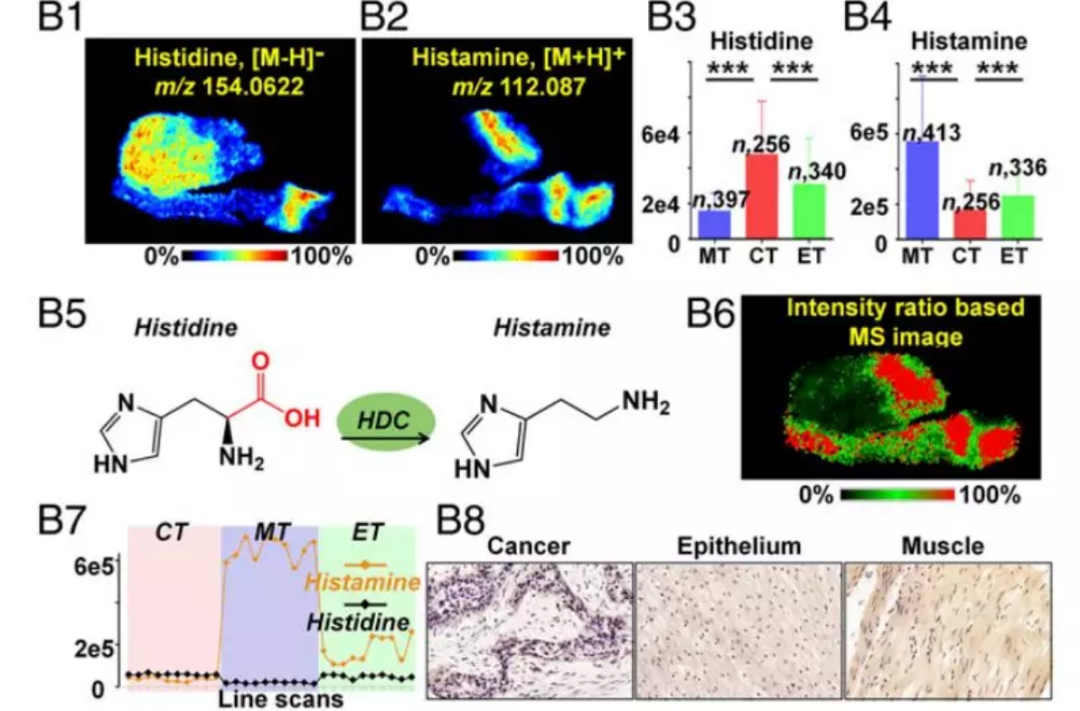
图 3B | 组胺代谢途径中关键代谢物和代谢酶的原位分析
(B1,B2)组氨酸和组胺质谱成像图(B3,B4)256 例鳞片状食管癌(ESCC)患者癌组织和相邻上皮、肌肉组织中组氨酸和组胺水平 (B5)HDC 介导的组氨酸转换为组胺的代谢过程(B6)根据组胺/组氨酸离子强度比值构建的质谱成像图(B7)癌组织和相邻上皮、肌肉组织中组氨酸和组胺的离子强度变化(B8) ESCC 不同区域 HDC 的表达
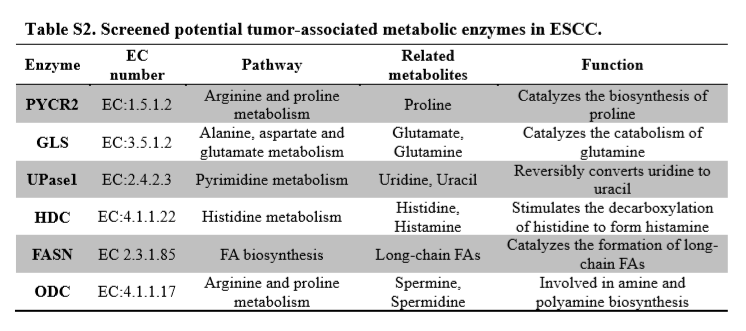
此外,发生改变的代谢途径还有谷氨酸代谢,脂肪酸合成以及多胺的生物合成,均在肿瘤组织中表现为显著增多,相应的免疫组化结果也证明与上述途径有关的关键代谢酶在癌区的表达也明显上调。以下(表1)为通过 256 例食管癌患者组织样本筛选出的发生改变的 6 条代谢途径和相应的关键代谢酶:
表1 | 筛选出癌症相关的代谢产物、代谢酶、代谢途径
研究结论:
该研究建立了一种高灵敏的空间分辨的原位代谢组学方法(空间代谢组学),对食管癌潜在原位标志物进行了代谢通路分析,并对通路上相关联代谢物的分布特征进行原位可视化表征,分析其空间变化趋势,发现了并验证了 6 个在食管癌中异常表达的代谢酶:吡咯-5-羧酸还原酶 2(PYCR2)、谷氨酰胺酶(GLS)、尿苷磷酸化酶 1(UPase1)、组氨酸脱羧酶(HDC)、脂肪酸合成酶(FASN)和鸟氨酸脱羧酶(ODC),它们广泛参与食管癌相关的肿瘤代谢过程,其中 PYCR2 和 UPase1 被首次发现在食管癌中异常改变。研究结果表明脯氨酸生物合成,谷氨酸代谢,尿苷代谢,组氨酸代谢,脂肪酸合成,多胺生物合成等代谢通路在食管癌组织中发生了显著变化。这些癌症代谢相关信息有助于增加对癌症代谢重编程的理解。
基于 AFADESI-MSI 技术的空间分辨原位代谢组学方法,不仅可验证肿瘤原位标志物的可靠性;同时针对肿瘤等具有复杂结构的组织,它具有原位、无需特殊标记、无需复杂耗时的前处理及反复染色过程,能够高通量地发现肿瘤异常变化的代谢通路及其代谢酶等优势;可从代谢物和代谢酶两个层次全面表征肿瘤的代谢改变并发现其潜在功能,为深入探究肿瘤的代谢改变提供了全新的研究视角。