Immunity:北大蒋争凡课题组发现 STING 后高尔基体囊泡转运的重要性及机制
丁香学术
cGAS-STING 通路是负责识别胞质 DNA 免疫应答的主要通路 1。cGAS 作为胞质 DNA 受体,可以被 DNA 和/或 Mn2+ 激活并利用 ATP 和 GTP 合成第二信使 2'3'-cGAMP,后者进一步激活 STING 并诱导 I 型干扰素等细胞因子的产生,从而介导抗病毒/肿瘤免疫反应。研究表明多种病原微生物入侵及各种压力胁迫,如氧化应激、代谢紊乱及 DNA 损伤等都可导致胞质 DNA 的累积及 Mn2+ 浓度的升高,从而激活 cGAS-STING 通路。因此,cGAS-STING 信号通路在抵抗病原微生物感染、肿瘤及多种免疫相关疾病的发生及治疗中都发挥关键作用。
磷脂酰肌醇磷酸(phosphoinositides, PIPs)是构成真核生物细胞膜组分的重要磷脂(占总磷脂的 5-10%),也是重要的信号分子 2。由于肌醇六元环上 D-3,D-4 或 D-5 位都可发生磷酸化修饰,因此真核生物中总共存在 7 种不同 PIP 分子。PI4P(phosphatydyinositol 4-phosphate)是胞内含量最高的 PIP 分子,广泛分布于各种膜组分,且在反式高尔基体(trans-Golgi network, TGN)上的含量最高。细胞中的 PI4P 的含量主要受其合成酶 PI4Ks (PI4KA, PI4KB, PI4K2A 和 PI4K2B) 和降解酶 SAC1 的调控。PI4P 不仅是合成 PIP2 和 PIP3 的前体,也是重要的信号分子,在膜泡运输、脂质转运和细胞器形态维持等方面发挥关键作用。
2021 年蒋争凡实验室利用 STING 自激活突变体诱导细胞死亡的特性,在 HT080 细胞中进行了基于 CRISPR-Cas9 介导的全基因组筛选,发现高尔基体腔内合成的硫酸化糖胺聚糖(sGAGs)可以通过结合到 STING 跨膜区的腔内侧,从而诱导 STING 的寡聚及激活 3。该论文的讨论部分提到 STING 和 sGAGs 的相互作用受到 STING 腔内侧 pH 值的调控,并由此推测 STING 在 pH 更低的后高尔基体囊泡(post-Golgi vesicles)中会有更高的活性。但是在这个研究中,他们没有解释 STING 为什么需要及如何转运到后高尔基体囊泡。
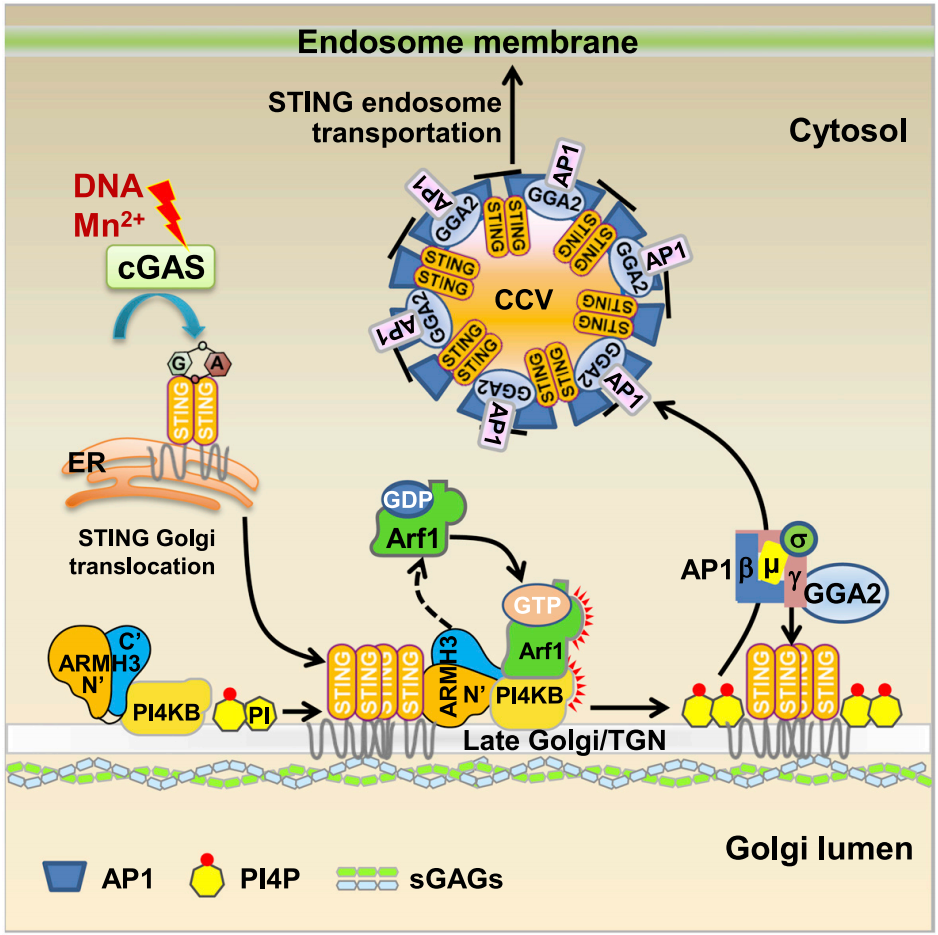
2023 年 3 月 14 日,北京大学生命科学学院蒋争凡实验室在 Immunity 上以 research article 形式在线发表了 ARMH3-mediated recruitment of PI4KB directs Golgi-to-endosome trafficking and activation of the antiviral effector STING,报道了 ARMH3 作为接头蛋白招募 PI4KB 到 STING,PI4KB 通过合成 PI4P 促进 STING 从高尔基体到内体的转运(Golgi-to-endosome trafficking)及维持 STING 激活所需要的脂膜环境(lipid environment),从而帮助 STING 更加稳定高效的激活。
本工作首先通过 CRISPR-Cas9 介导的全基因组筛选在 HeLa 细胞系中鉴定到一个未知功能的新基因 C10ORF76 (又名 ARMH3) 对 STING 的激活十分重要。ARMH3 是一个鲜少被研究的蛋白,为数不多的几篇文章暗示了它对于 PI4KB 发挥激酶活性来磷酸化磷脂酰肌醇(phosphatidylinositol,PI)生成 PI4P 十分重要。免疫荧光实验发现 STING 激活后和 ARMH3,PI4KB 及 PI4P 都在反式高尔基体有明显的共定位。进一步免疫共沉淀实验显示,STING 只有在 ARMH3 存在的情况下和 PI4KB 有互作,表明 ARMH3 在 STING 和 PI4KB 之间起到桥梁作用。
进一步实验表明 ARMH3 分别结合位于 STING 第二、三跨膜区直之间的连接区域及位于 PI4KB 激酶结构域中间的连接区域。突变掉 STING 负责结合 ARMH3 的氨基酸或者利用 CRISPR-Cas9 原位删除 PI4KB 与 ARMH3 互作的关键区域(6 个氨基酸残基)都会显著削弱 cGAS-STING 通路的激活。这些结果表明 ARMH3 招募 PI4KB 对于 STING 的激活十分关键。
更重要的是,细胞内敲除 ARMH3 或者原位删除 PI4KB 结合 ARMH3 所需的 6 个氨基酸,STING 在上游通路活化后几乎呈现完全的内质网定位,暗示如果 2'3'-cGAMP 结合后被转运到高尔基体的 STING 无法被继续转运到后高尔基体囊泡,将会被细胞内 COPI/AP1 介导的从高尔基体向内质网的逆向转运运回内质网,并完全抑制 STING 的活化。
为了更直接的研究 PI4KB 对 STING 激活的影响,他们使用雷帕霉素诱导的 FKBP 和 FRB 相互作用,直接招募 PI4KB-GFP-FKBP 到 STING-mCherry-FRB,并发现招募 PI4KB 到 STING 会显著促进 STING 聚集体的形成及下游信号通路的激活,且这种对于 STING 通路的激活能力完全依赖于 PI4KB 的激酶活性。相反,招募 PI4P 的磷酸酶 SAC1 到 STING 则会抑制 STING 聚集体的形成及下游信号通路的激活。表明 PI4KB 通过在 STING 周围合成 PI4P 促进 STING 的激活。有趣的是,SAC1 的敲低会引起的细胞内 PI4P 水平的异常升高,进而导致 STING 不依赖于 cGAS 的自激活。TMEM39A 是一个自身免疫性疾病相关基因且被报道参与细胞内的 PI4P 水平的调控 4。同样,TMEM39A 的敲低也会导致细胞内 PI4P 的水平的异常升高及 STING 的自激活,该发现有助于理解 TMEM39A 相关自身免疫疾病的致病机制。此外,SCAP 和 NPC1 的突变也被报道可以引起细胞内 PI4P 的水平的异常升高及 STING 的自激活 5-8,提示胞内 PI4P 水平的异常升高可能是这些基因突变导致 STING 自激活的共同原因。
为了研究 PI4P 如何影响 STING 的激活,他们对 23 个 PI4P 结合蛋白进行了系统性地敲低并发现其中 9 个成员的降低表达会使 STING 的激活严重受损。功能分析表明这 9 个 PI4P 结合蛋白可以分为两类。其中 AP-1 和 GGA2 负责介导高尔基体到内体的膜泡运输。由于内体中相对更低的 pH 值有利于 STING 与 sGAGs 的结合,他们推测 PI4P 可以通过指导 AP-1 和 GGA2 介导的 clathrin-coated vesicles (CCVs) 将 STING 从高尔基体转运到内体从而避免 STING 被运回内质网,并且更加强烈激活 STING。另一类 PI4P 结合蛋白均为脂质转运蛋白,其中 OSBP 和 ORPs 负责从内质网向高尔基体或内体转运胆固醇,CERT 负责神经酰胺从内质网到高尔基体的转运。神经酰胺在高尔基体上会在 SGSM1 的催化下转化为鞘磷脂,且 SGSM1 在细胞内的敲除会显著削弱 STING 的激活,提示鞘磷脂而非神经酰胺直接作用于 STING。通过特异的化学小分子破坏胆固醇和鞘磷脂在脂膜上的分布会使 STING 聚集体逐渐消散并显著抑制 STING 下游信号通路的激活,表明胆固醇和鞘磷脂对 STING 聚集体的形成和激活十分关键。以上结果共同表明 PI4P 还可以通过脂质转运蛋白维持 STING 活化所需的脂膜环境进而影响 STING 的激活。此外,Lyz-Cre 介导的 Armh3 条件敲除小鼠实验表明 Armh3 在机体对抗 DNA 病毒感染过程中发挥关键作用。
综上所述,该研究发现:
1)STING 为什么需要离开及如何离开高尔基体(后高尔基体转运)的分子机制(下图);
2)一个未知功能的接头蛋白 ARMH3(可能还具有 GEF 活性,激活膜泡转运中非常重要的 Small GTPase Arf1)在 cGAS-STING 通路中的重要作用;
3)脂膜环境对 STING 的活化十分关键及必要;
4)细胞内 PI4P 水平的异常升高可以导致非依赖于 cGAS 的 STING 蛋白自激活(cGAS-independent STING autoactivation)。
重要的是,这种现象在很多脂质代谢紊乱的自身免疫病患者中被发现及报道。鉴于 PI4P 在脂质运输及脂质稳态维持中的核心作用,他们的研究还提示 STING 作为一个潜在的细胞脂质稳态感受器(lipid homeostasis sensor),可能是细胞内的一种新型危险信号感受器。
北京大学生科院博士后方润和蒋启飞为该文章的共同第一作者,2022 级研究生贾新颖也为本研究做出贡献。生科院/北大-清华生命科学联合中心的蒋争凡教授为通讯作者。
原文链接:
https://doi.org/10.1016/j.immuni.2023.02.004
参考文献:
1 Fang, R. et al. Recent advances in the activation and regulation of the cGAS-STING pathway. Advances in Immunology 156, 55-102, doi:10.1016 /bs.ai.2022.09.003 (2022).
2 Posor, Y. et al. Phosphoinositides as membrane organizers. Nat Rev Mol Cell Biol, doi:10.1038/s41580-022-00490-x (2022).
3 Fang, R. et al. Golgi apparatus-synthesized sulfated glycosaminoglycans mediate polymerization and activation of the cGAMP sensor STING. Immunity 54, 962-975, doi:10.1016 /j.immuni.2021.03.011 (2021).
4 Miao, G. et al. The ER-Localized Transmembrane Protein TMEM39A/SUSR2 Regulates Autophagy by Controlling the Trafficking of the PtdIns(4)P Phosphatase SAC1. Mol Cell 77, 618-632 e615, doi:10.1016/j.molcel.2019.10.035 (2020).
5 Wakana, Y. et al. The ER cholesterol sensor SCAP promotes CARTS biogenesis at ER-Golgi membrane contact sites. J Cell Biol 220, doi:10.1083/jcb.202002150 (2021).
6 Kutchukian, C. et al. NPC1 regulates the distribution of phosphatidylinositol 4-kinases at Golgi and lysosomal membranes. EMBO J 40, e105990, doi:10.15252/embj.2020105990 (2021).
7 York, G. et al. Limiting Cholesterol Biosynthetic Flux Spontaneously Engages Type I IFN Signaling. Cell 163, 1716-1729, doi:10.1016/j.cell.2015.11.045 (2015).
8 Chu, T. et al. Tonic prime-boost of STING signalling mediates Niemann-Pick disease type C. Nature 596, 570-575, doi:10.1038/s41586-021-03762-2 (2021).