Adv Sci:林戈/薛愿超合作阐明 eIF4E1B 在哺乳动物卵母细胞向胚胎转换过程中母源 mRNA 选择性翻译的作用机制
丁香学术
2023 年 2 月 8 日,中南大学/中信湘雅生殖与遗传医院林戈教授团队联合中科院生物物理所薛愿超实验室在 Advanced Science 杂志上在线发表了题为 Selective Translation of Maternal mRNA by eIF4E1B Controls Oocyte to Embryo Transition 的研究论文,首次报道了卵母细胞内特异的翻译起始因子 eIF4E1B 在哺乳动物卵母细胞向胚胎转换过程中的生理功能,同时也提出在卵母细胞中存在的特异翻译激活模型。
生殖细胞对个体生殖和种群延续至关重要,卵细胞中积累的蛋白质和 RNA 为早期胚胎发育奠定了物质基础。在卵母细胞向胚胎转换(OET, oocyte-to-embryo transition)的过程中,基因组转录活性在卵母细胞成熟的最后阶段逐渐降低直至完全停滞,那些卵母细胞不同发育阶段所转录的信使核糖核酸(mRNA)都需要在特定发育阶段被选择性激活翻译,以合成蛋白质参与卵子发生、母体胚胎转换(Maternal-to-zygotic transition,MZT)及早期胚胎的发育等过程。然而在不同细胞中,选择性激活 mRNA 翻译的机制是复杂多变的,卵母细胞向胚胎转换过程中的不同阶段,mRNA 被选择性激活的具体分子机制是什么?这仍是雌性生殖生物学中的不解之谜。
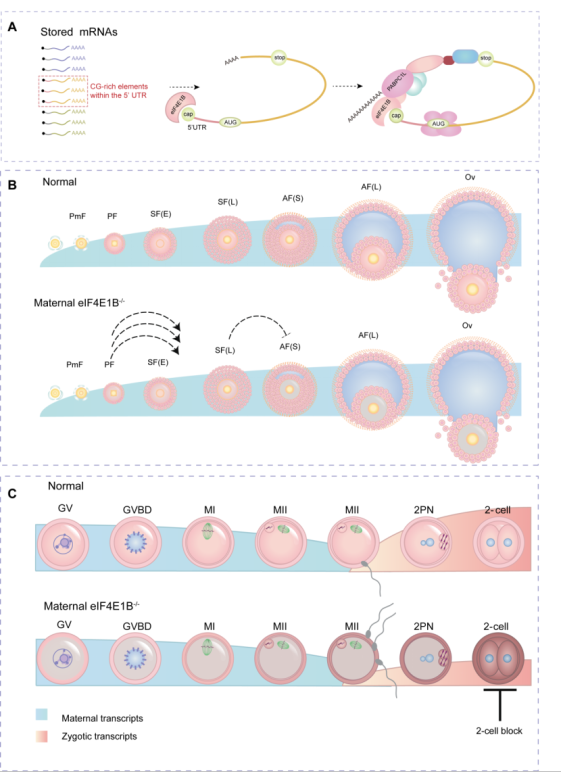
研究发现:eIF4E1B 在卵母细胞内特异表达,在初级卵泡发育阶段开始逐渐累积,持续表达至二细胞阶段,并且在卵母细胞成熟的过程中,随着核膜破裂、纺锤体形成,其动态定位变化与卵母细胞成熟过程中新生蛋白的信号存在共定位趋势;这些表达趋势提示 eIF4E1B 在 OET 过程中起重要作用。利用 CRISPR/Cas9 和 Zp3-Cre/loxP 技术将 eIF4E1B 敲除后,发现 eIF4E1B 条件性敲除缺失小鼠完全不孕,主要表现在卵泡发育,卵母细胞受精障碍,二细胞阻滞等多个事件中。这提示 eIF4E1B 时空特异性参与调控母源 mRNA 的翻译。
而翻译的启动是整个翻译过程关键的限速步骤,受到 mRNA 5′和 3′非翻译区(Untranslated Regions,UTR)的顺式作用元件及与之结合的反式作用因子的影响。那么翻译起始因子作为参与翻译激活事件的关键 RBP,其在卵母细胞向胚胎转换过程中靶向性结合了哪些 mRNA?这些 RNA 是否共同存在着特殊的调控元件?
中南大学/中信湘雅生殖与遗传医院林戈教授团队联合中科院生物物理所薛愿超教授团队,利用 LACE-seq 技术明确了翻译起始因子 eIF4E1B 所结合的靶标 mRNA,通过进一步分析发现其倾向性结合在靶标 mRNA 的 5′和 3′UTR 区域。为了明确 eIF4E1B 在卵母细胞翻译激活过程中的选择性作用,研究人员比较了经典翻译起始因子 eIF4E 和 eIF4E1B 所结合靶标 mRNA 的差异,发现不同亚型的翻译起始因子能靶向结合特定的 mRNA,而 eIF4E1B 倾向结合在 mRNA 5′UTR 的 CCGCC 序列,这提示 mRNA 的非编码区存在特定的调控元件,这些元件可能调控卵母细胞内 mRNA 的选择性翻译激活。
此外,研究人员进一步通过蛋白质谱验证了 eIF4E1B 靶向结合的 mRNA 在蛋白水平的变化并利用免疫共沉淀-蛋白质谱鉴定并验证了与 eIF4E1B 相互作用参与翻译起始过程的蛋白互作网络,最后,研究团队预测了翻译起始因子 eIF4E1B 协同 3′UTR 结合蛋白选择性募集 5′UTR 富含 CCGCC 序列的 mRNA,激活其在卵母细胞向胚胎转换过程中的翻译,以参与卵子发生,卵母细胞成熟,受精及早期胚胎发育等关键事件。
该研究首次对哺乳动物 eIF4E1B 的功能进行解析,阐明 eIF4E1B 作为卵母细胞内独特的翻译起始因子,其缺陷会影响卵母细胞向胚胎转换过程中的诸多事件,最终导致二细胞阻滞。此外,研究中描绘了 eIF4E1B 靶向结合的 mRNA 特征图谱,并在此基础上首次预测了卵母细胞内特异的翻译起始因子 eIF4E1B 参与哺乳动物母源 mRNA 在卵母细胞向胚胎转换过程的「闭环」模型:翻译起始因子协同 3′UTR 结合蛋白选择性募集 5′UTR 富含 CCGCC 序列的 mRNA(图 A),激活其在卵母细胞向胚胎转换过程中的翻译,以参与卵子发生,卵母细胞成熟,受精及早期胚胎发育等关键事件(图 B, C)。这一重要工作为将来挖掘参与哺乳动物卵母细胞向胚胎转换过程中的关键蛋白提供了参考,同时也将为研究人类卵母细胞向胚胎转换过程中的母源 mRNA 翻译调控奠定了坚实的基础。