诺奖得主 Science 发文:基因编辑诞生 10 年,未来将如何改变世界?
丁香学术
前言
簇状规则间隔短回文重复(CRISPR)基因组编辑的出现,以及计算和成像能力的进步,使得编辑细胞和生物体中的 DNA 片段或特定的碱基对成为可能。从遗传病到农业实践和产品,CRISPR 工具箱及其应用深刻地影响了生物学研究。
通过 CRISPR-Cas9,我们不仅可以诊断人类疾病,甚至可以根据个人遗传学预测个体易感性,还可以根据这些信息设计治疗策略。同样,我们既可以识别并快速改变负责植物性状的基因,又可以优化农业研究和植物育种。
2012 年 6 月,Jennifer Doudna(因 CRISPR 获诺贝尔化学奖)和她的同事们在 Science 发表了一项对细菌基因的研究结果。当时,它并没有引起学术圈的热点关注。十年以来,基因编辑领域的研究飞速发展,从基因编辑方法的创新、编辑精度及效率的改进,再到人类疾病的治疗以及农业研究的应用,基因编辑毫无疑问正在改变我们的生活。
2023 年 1 月 19 日,Joy Wang 和 Jennifer Doudna(因 CRISPR 获诺贝尔化学奖)在 Science 上发表了相关综述,重点介绍了过去十年里 CRISPR 基因组编辑的重要进展、当前的局限性以及对未来的前景展望。
来源:Science
研究背景
碱基编辑是生成特定精确碱基修改的广泛策略。在过去的十年中, CRISPR 技术作为强普适性的工具被用于探测生物学功能、剖析遗传互作机制并针对人类疾病和工程作物提供优化策略。
研究人员在细菌和古细菌中发现了神秘 DNA 序列,即簇状规则间隔短回文重复(CRISPR),通常与微生物基因组中具有编码 CRISPR 相关蛋白共同出现。CRISPR 内部与病毒相匹配的短 DNA 序列说明这些系统发挥调节免疫通路的功能,用于预防病毒感染。(图 1A)随着研究的深入,科学家们揭示了 CRISPR 系统如何使用从序列转录的 RNA 分子阵列引导 Cas 蛋白切割,从而破坏病毒 DNA 或 RNA。
CRISPR-Cas9 基因编辑技术就是通过人工设计的 sgRNA(guide RNA)来识别目的基因组序列,并引导 Cas9 蛋白酶进行有效切割 DNA 双链,形成双链断裂,损伤后修复会造成基因敲除或敲入等,最终达到对基因组 DNA 进行修饰的目的。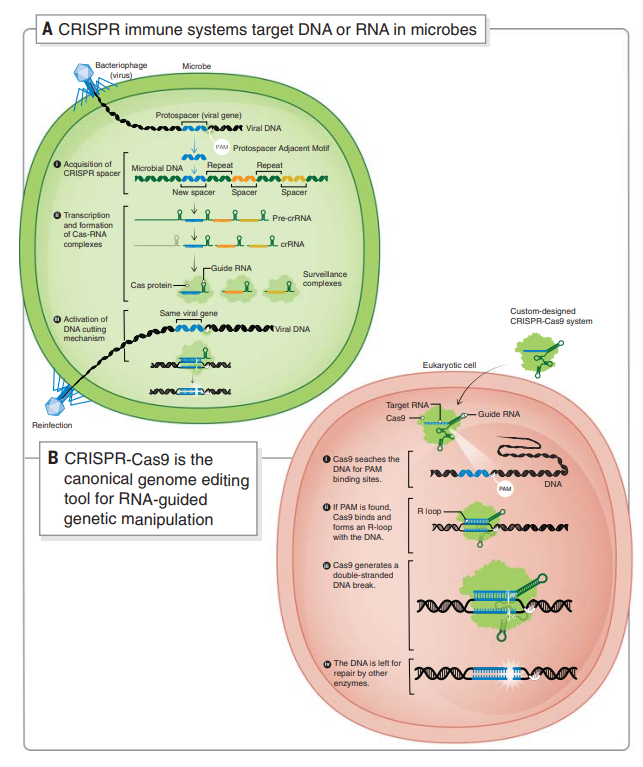
图 1. 基于 CRISPR 的适应性免疫提供了可编程的基因组编辑工具。(A)CRISPR 免疫系统靶向微生物中的 DNA 或 RNA。(B)CRISPR-Cas9 是用于 RNA 引导的遗传操作的规范基因组编辑工具。(来源:Science)
CRISPR 诱导的基因敲除
CRISPR-Cas9 具有高靶向特异性和有效性,能够成功快速创建敲除小鼠和其他动物模型(图 2B)。传统的基因靶向方法需要在胚胎干细胞(ES)中使用低效的同源重组,然后费力地筛选修饰的 ES 细胞以获得所需的序列变化并注射到胚胎中。而 CRISPR-Cas9 能够在单细胞胚胎中引入双链 DNA 断裂,绕过了筛选适合 ES 细胞的阶段,这使构建转基因小鼠所需的时间从 1 年减少到 4 周。
除了种系编辑之外,CRISPR-Cas9 还用于体细胞编辑,可以准确模拟癌症发展并提供治疗模式。体内递送策略的进步扩展了可以创建的体细胞动物模型的类型。
通过 CRISPR 基因组工程方法,已经为许多疾病开发了动物模型,包括酪氨酸血症、杜氏肌营养不良症、癌症、骨质疏松症、亨廷顿病、肌萎缩侧索硬化症、阿尔茨海默病和 HIV-1/AIDS 等。动物模型的快速创建将继续推进遗传疾病中特定遗传变异和疾病因果关系的解析,并有助于开发和测试新疗法。
此外,CRISPR 多重基因组编辑(同时靶向多个特定 DNA 位点)已成为创建新的作物基因型和农业有用性状的成功策略,特别是在作物驯化和改良上,包括使用多重编辑来破坏驯化基因,引入除草剂抗性等特征,并提高作物产量和质量(图 2D)。
CRISPR 诱导的修饰适用于同步编辑多位点,即使用多个 gRNA 及一种 Cas 蛋白用于编辑不同的靶标。这对于编辑携带靶基因多个拷贝的作物物种(例如,六倍体小麦)和作物驯化特别有用。
特定碱基位点的编辑修改
点突变是人类致病性遗传变异的最大类别,特定于位点的编辑修改拓宽了研究基因点突变的能力,并且可以通过纠正点突变来治疗遗传性疾病。此外,碱基编辑可以在有丝分裂和无丝分裂细胞中引入修饰。
CRISPR 碱基编辑器通常由 Cas9 切口酶(nCas9)和催化核碱基脱氨反应的酶融合组成。sgRNA 将 nCas9-脱氨酶融合引导至基因组靶标,形成三元复合物,将 ssDNA 区域暴露于脱氨酶以进行化学修饰,由此产生的碱基错配随后通过细胞修复机制解决。在过去的几年中,DNA 和 RNA 碱基编辑器的工具箱已经扩展到支持 C>T,A>G,C>G,A>I 和 C>U 转换。
碱基编辑已经在纠正许多小鼠模型中的功能丧失突变方面取得有希望的结果,最近使用体内碱基编辑纠正了小鼠的 Hutchinson Gilford 早衰综合征。使用碱基编辑治疗家族性高胆固醇血症的早期临床试验已经开始,使用碱基编辑治疗镰状细胞病的临床试验也将于今年开始启动。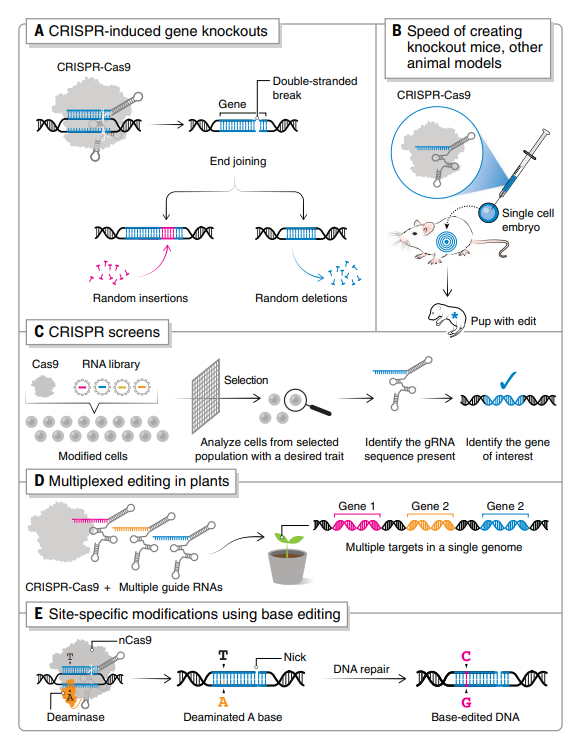
图 2. 基因组编辑应用(A)CRISPR 诱导的基因敲除;(B)创建 KO 小鼠和其他动物模型(C)用于功能性遗传筛选;(D)植物中的多重编辑平台;(E)CRISPR 碱基编辑器。(来源:Science)
关键挑战——编辑准确性和精确性
下一个十年 CRISPR 基因组编辑需要解决的关键挑战包括编辑准确性(即目标位点的特异性)和精度(即产生确切的所需编辑结果)(图 3A)。
当有多个目标碱基时,基因编辑器的修复准确度大幅下降,限制了其治疗潜力。在最近的一项研究,大约一半的致病性单核苷酸变体可由腺嘌呤碱基编辑纠正(≥ 50% 校正精度)。然而,在包含多个致病性单核苷酸变异的窗口中编辑目标碱基,只有 26% 显示校正精度 ≥ 50%。
为了减少 CRISPR-Cas 核酸酶因意外结合切割而产生的脱靶效应,目前通过使用高保真 CAS 变体和合理设计去氨基酸结合结构,以减少不依赖 Cas 的核酸结合。同时,使用新方法将 CAS 编辑器递送到目标位点并优化现有编辑器可以同时尽量减少脱靶效应。
此外,将碱基编辑器融合到 Gam(来源于噬菌体 Mu 蛋白,可以结合在 DNA 双链断裂的末端,保护 DNA 不被降解) 可以最大限度地减少碱基编辑过程中的 indel(插入缺失)形成。
编辑精度面临着更大的挑战。目前在真核细胞的传统 CRISPR-Cas9 编辑中仍然不能完全控制引入 DSB 后的编辑结果。提高编辑精度则需要更好地了解 DNA 修复过程,最近的机器学习工具已被开发来帮助预测修复结果(图 3B)。减小编辑大小窗口可以提高精度,而这也限制了由于 PAM 限制而可以靶向的基因组位点。需要进一步的工程设计来构建当前开发较窄的基础编辑器的策略编辑窗口和不同的 PAM 兼容性,而不会影响效率和定位特异性。
先导编辑
先导编辑(Prime Editing)是由哈佛大学博德研究所 David Liu 实验室在传统的 CRISPR/Cas9 基础上优化的精准基因编辑系统。Prime editing 由两部分组成,一是 nCas9 和改造的逆转录酶融合构成的效应蛋白 ——Cas9-逆转录酶,其二是工程编辑向导 RNA (prime editing guide RNA, pegRNA) 。后者既可以将 nCas9 引导到目标位点,又可以作为包含逆转录酶所需编辑的模板。这种方法可用于纠正人类细胞中与 hunter 综合征相关的大型序列倒置,效率高达 9%,且没有检测到的脱靶插入。
先导编辑(Prime Editing)提供了一种可以插入和删除 DNA 序列的替代方案(图 3C),可以在分裂细胞和非分裂细胞中引入修饰,这对于纠正静止细胞 (如神经元或造血干细胞) 中诱导突变非常有用。
在未来十年,先导编辑的主要目标是在不影响编辑精准度的情况下提高编辑效率。
体外和体内递送编辑器
尽管 CRISPR 编辑技术最近取得了长足的进步,但是将编辑器递送至生物体仍然是基因组编辑的一大瓶颈。
当前,基于 CRISPR 实现人类基因编辑以治疗疾病的策略分为两种:体外基因编辑,从患者体内采集细胞后,在体外进行基因编辑改造,之后再重新注入患者体内;体内基因编辑,在患者体内直接改造相关致病基因,使用某种载体将 CRISPR-Cas9 系统递送至目标器官或组织。
体外基因编辑通常用于编辑造血干细胞和祖细胞及白细胞,具有更高的细胞类型特异性和更严格的编辑质量,但可以在培养中存活增殖并保留体内活性的细胞类型有限。
体内基因编辑中,CRISPR 的编辑仍然是一个艰巨挑战,在递送载体中需要防止物质降解、毒化和从血管外渗出的吞噬作用,以及需要保证通过间质空间并释放物质的有效性(图 3D)。
目前,存在多种用于哺乳动物系统中 CRISPR 基因编辑的递送方式,广泛划分为进入物理递送、基于病毒的递送,以及基于合成材料的递送。常见的物理递送方法包括显微注射和电穿孔,允许控制剂量,效率递送高,但仅限于离体递送。基于病毒的递送方式包括腺病毒、腺相关病毒和慢病毒,它们以质粒 DNA 的形式通过载体传播,具有良好的效率。基于合成材料的递送方法更安全且有高水平的控制和灵活性,但其效率要低于病毒, 递送效率受到材料的体积和阳离子性质的限制,易导致间质分散不良。
因此,改进当前的递送策略,创新递送方式,发现和设计更紧凑的 CRISPR 编辑器, 是提高 CRISPR 未来人类治疗的出路。
图 3. 基因组编辑的挑战和新兴工具。(A)编辑准确性与精度;(B)使用大多数 SNP 校正的不精确性;(C)同源定向修复(HDR)介导的基因序列插入;(D)基因编辑器递送的挑战。(来源:Science)
现有应用及未来展望
可编程基因组编辑的出现为细胞和基因疗法的应用铺平了道路。目前,FDA 至少批准了八项基于 CRISPR 和相关血液疾病的临床试验。
通过 CRISPR,既可以预测个体疾病的发生和易感性,也可以对其进行操纵。还可以快速识别和改变负责植物性状的基因,从而加快农业生产步伐和植物育种。DNA 测序的发展及计算和成像能力的进步,未来 CRISPR 将会有更多的应用平台(图 4)。
过去十年,更多关注的是 CRISPR 平台样,未来十年将越来越多地将这些平台应用于现实世界。在临床方面,我们无疑将看到越来越多的临床试验,为指导下一代基因和细胞疗法提供数据。随着临床应用的扩大,CRISPR 可能会被用于保护健康。例如,随着疾病治疗的安全性和有效性的确立,基因组编辑可能成为预防神经退行性疾病或心血管疾病的一种手段。
在农业领域,CRISPR 筛选将为在植物和动物中设计多基因性状的途径提供越来越多的见解。使用 CRISPR 生成的产品,无论是用于移植患者的猪器官,抗干旱并产量提高的水稻,还是使用 CRISPR 编辑对健康进行微调的微生物群落,都可能成为常规产品。

图 4. 未来方向:10 年后 CRISPR 基因组编辑的未来将与机器学习、活细胞成像和测序等技术的进步融合。(来源:Science) CRISPR 技术的过去与未来(来源:Science)
CRISPR 技术的过去与未来(来源:Science)