盘点∣类风湿性关节炎的动物模型有哪些?
集萃药康
类风湿性关节炎(rheumatoid arthritis,RA)是一种慢性、对称性、多关节病变为特征的自身免疫性疾病,主要表现为滑膜炎、软骨及骨破坏[1]。据统计,RA 每年的全球患病率为 0.5%-1%,其中女性患者多发于男性[2]。
图片来源:图虫创意
RA 发病机制尚不完全清楚,实验动物模型作为类风湿关节炎研究的重要载体,能在一定程度上模拟人类疾病,因此,选择合适的动物模型对于研究 RA 的发病机制、开发新药及制定防治方案等具有重要意义。目前,RA 动物模型主要使用啮齿类大小鼠,其优势在于遗传背景稳定,操作方便且经济。RA 模型大致可分为诱导型和转基因型两大类,本文将针对这两大类模型进行总结和比较,以便广大学者为自己的研究选择合适的 RA 模型。
一、诱导型类风湿关节炎模型
目前,最常见的诱导型类风湿关节炎模型包括佐剂诱导关节炎(Adjuvant arthritis,AA)、胶原诱导的关节炎(Collagen-induced Arthritis, CIA)、胶原抗体诱导的关节炎(Collagen antibody-induced Arthritis, CAIA)以及其他的药物如降植烷等进行诱导的关节炎模型,不同诱导型 RA 动物模型所反映的 RA 特征和免疫机制也是有所不同的。因此,可结合课题特点和实验设计选择具体的动物品系和诱导方式。
1. 佐剂诱导的关节炎(AA)
AA 最早由 Freund 于 20 世纪 50 年代创立,又称弗氏佐剂关节炎模型,介导的溶剂可分为完全佐剂(CFA)和不完全佐剂(IFA)两种。作为研究免疫性关节炎动物的基本模型之一,可用于 RA 药物药效测试。
造模机制[3]:基于抗原模拟机制,位于结核杆菌的一个蛋白分子 MtbH37Ra 与关节滑膜上的一个糖蛋白分子 HSP650 结构相似,可以被同一株T细胞克隆所识别,从而诱发针对关节的免疫反应。
具体操作[4]:通过大鼠尾根部或足跖部皮下注射含有灭活分枝杆菌(Mtb)或减毒卡介苗的完全弗氏佐剂进行免疫诱导。模型一般于致炎后 10-20d 出现发炎性症状,约在 20d 达到高峰。炎症主要以踝关节为重,可侵及足垫和全足。
模型特点:模型制备方法简单,发病较快,临床表现类似 RA;但在病理生理学特点上存在一定差别,如 RA 患者多同时表现出体液和细胞免疫功能的异常,而 AA 大鼠会出现免疫功能紊乱,且缺乏慢性病理过程,有一定的局限性。
2. 胶原诱导的关节炎(CIA)
CIA 是 Trentham[5] 等 1977 建立的实验性关节炎动物模型,多种动物的 Ⅱ 型胶原均可引起关节炎,但多用啮齿类和灵长类。CIA 作为一种内源性自身抗原介导自身免疫性疾病,是目前研究 RA 的金标准模型[6]。
造模机制:胶原蛋白(collagen)是细胞外间质成分,分为 Ⅰ 型、Ⅱ 型和 Ⅲ 型,其中 Ⅱ 型胶原大量存在于关节软骨中。当用异源性 Ⅱ 型胶原(如牛 CⅡ 或鸡 CⅡ)来免疫动物,可诱导体内产生针对关节软骨中的 Ⅱ 型胶原的自身免疫反应。
具体操作[7]:通过关节软骨主要构成蛋白 Ⅱ 型胶原蛋白(CⅡ)与完全弗氏佐剂等量混合制备成乳剂进行免疫诱导,初次免疫后 d26-d35 发病,小鼠出现关节肿胀、活动受限甚至会发生溃烂和变形的现象。常用高敏感品系 DBA/1 小鼠,发病率高,可重复性好但价格昂贵。另一种经济型低敏感品系 C57BL/6 小鼠对鸡 CⅡ 较敏感,对牛 CⅡ 胶原不敏感,可用鸡 CⅡ/CFA 乳化剂免疫产生关节炎。
模型特点:CIA 造模动物骨性改变更加明显,RA 持续时间更长,但其起病较缓慢,没有病情的波动和复发情况,也没有关节外皮肤及眼部表现的改变。
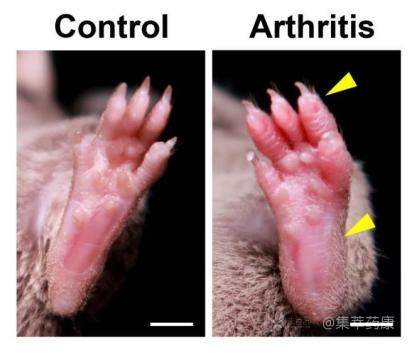
图为集萃药康 Male DBA/1J 诱导模型
3. 胶原抗体诱导的关节炎(CAIA)
CAIA 属于 CIA 模型的扩展,是抗体诱导型关节炎模型中最常见的模型之一。与 CIA 依赖的 MHC 单倍型易感品系相比,CAIA 可在大多数小鼠上诱导关节炎,如 DBA/1、BALB/c、C57BL/6、C57BL/10 等小鼠[8]。
造模机制:通过靶向 Ⅱ 型胶原蛋白的各种表位的抗体混合物来诱导关节炎的发生。
具体操作:8 周龄的雄性 DBA/1 小鼠,在 0d 时腹膜腔注射鼠单克隆 II 型胶原抗体,3d 后腹膜腔注射大肠杆菌脂多糖(LPS)。初次免疫后 d4 有炎症迹象,d6-d8 关节炎达到最严重,出现足踝和足趾明显红肿、炎症细胞浸润和血管翳形成等症状[9-10]。
模型特点:作为 CIA 模型的扩展,CAIA 模型可用于不适合 CIA 的菌株或基因型,并在短时间内快速发病,发病率、可重复性及稳定性较高,但所需试剂昂贵,造模成本偏高。
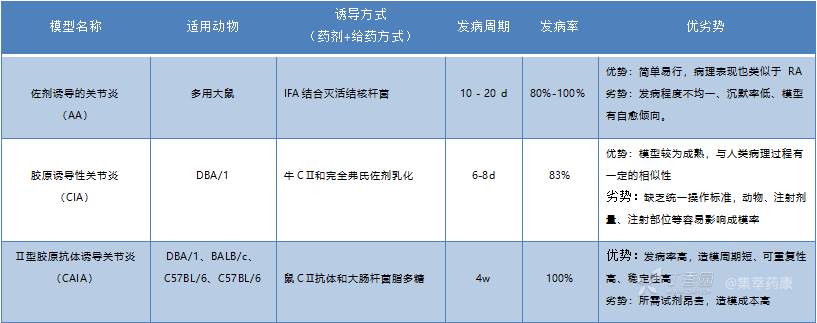
表 1. 常用诱导型类风湿性关节炎模型比较
4. 其他的药物诱导模型
类风湿关节炎作为近年来国内外研究的热点,除了上述常见的三种诱导模型之外,还有很多其他的诱导模型,如链球菌细胞壁诱导的关节炎,在注射 24h 后即可出现明显的急性关节炎症状,后期可演变成长期慢性关节炎,可用于研究免疫细胞炎症机制;降植烷诱导的关节炎通过降植烷诱导小鼠产生红斑狼疮特异性抗体,表现系统性红斑狼疮特征,进而导致关节炎症发生;蛋白聚糖诱导的关节模型[11]是目前唯一侵犯中轴骨系统的系统性自身免疫小鼠模型,是目前研究脊柱关节炎的热点模型。
二、转基因型关节炎
转基因型 RA 动物模型主要选用啮齿类小鼠作为受体,利用转基因技术将特定基因转移到小鼠体内,使其自发性发展具有关节炎特征的疾病。目前该模型发展有很多种类,其中人 TNF 转基因小鼠模型、K/BxN 转基因小鼠模型等都是研究分子靶向免疫制剂和发病机制的良好模型。
1. 人 TNF 转基因小鼠模型
TNF-α 转基因模型于 1991 年由 KOLLIAS 等[12]建立,通过修饰 C57BL/6 小鼠 3' 端的 UTR 区域,使其表达高水平 TNF-α,致自发性关节炎发生。
TNF-α 转基因模型小鼠 3~4 周时出现自发性慢性炎症,可见关节炎、滑膜增生及炎症细胞浸润等,小鼠在 10 周龄时发展成 RA,并有人 RA 相似的症状,如慢性进行性的对称性关节炎、血管翳形成、关节软骨及骨破坏。
2. K/BxN 转基因小鼠模型
K/BxN 转基因模型小鼠是 KRN T 细胞受体转基因小鼠与 C57BL/6x NOD 小鼠杂交的后代,是 BUTTGEREIT[13] 等 1996 年首次建立的自发性关节炎小鼠模型。该模型小鼠 3 - 4 周即可见关节炎急性发作,与 RA 临床症状相似。
特别之处在于该模型血清中存在大量自身抗体,Korganow AS[14]等将 K/BxN 小鼠血清转移到 B 细胞缺陷型K/BxN -μmol·L-1/小鼠,2d 内出现严重的关节肿胀等炎症症状,这种也称为 K/BxN 血清转移关节炎(K/BxN STA)模型。
除此之外其他的转基因 RA 模型还有 SKG 小鼠模型、IL-1 受体拮抗剂敲除小鼠模型、human/SCID 嵌合体小鼠模型等等。
随着对类风湿性关节炎研究的不断深入,关节炎动物模型也从诱导型关节炎发展至转基因型关节炎模型,对这些模型的研究都为 RA 的发病机制、治疗方法的探索做了一定的贡献。但目前已有的模型往往都只能在某一方面或多个方面体现人类 RA 的部分特征,并不能反映人 RA 疾病的全部特征,因此研究者需仔细评估各模型之间的优缺点,选择适合自己的动物模型开展试验研究。
参考文献
1. Smolen JS,et al.Rheumatoid arthritis[J].Nat Revdis Primers,2018,4:18001.
2. Safiri,et al.Global, regional and national burden of rheumatoid arthritis1990-2017: a systematic analysis of the Global Burden of Disease study 2017[J].Ann Rheum Dis 2019 Nov;78(11):1463-1471.
3. 刘琼,王晨瑶等.类风湿性关节炎动物模型的研究进展[J].医学综述,2006,25(5):313-316.
4. 李利青,张逢等.类风湿性关节炎实验性动物模型的研究进展[J]中国药理学通报,2021,37(11):1492-1496.
5. Trentham DE, et al. Autoimmunity to type Ⅱ collagen: an experimental model of arthritis.[J]. Exp,1977,146(3):857-866.
6. Brand D D.et al.Collagen-induced arthritis[J].Nat Protoc,2007,2(5):1269-1275.
7. 周茹,杨以阜等.Ⅱ型胶原诱导的小鼠关节炎动物模型的建立及影响因素[J].中国药理学通报,2006,22(12):1532-1535.
8. Khachigian L M.Collagen antibody-induced arthritis[J].Nat Protoc,2006,1(5):2512-6.
9. Terato k,et al.Induction arthritis with monoclonal antibodies to collagen[J].J Immunol,1992,148(7):2103-8.
10. Hutamekalin P,et al.Collagen antibody-induced arthritis in mice:Development of a new arthritogenic 5-clone cocktail of monoclonal anti-typeⅡcollagen antibodies[J].J Immunol Methods,2009,343(1):49-55.
11. 童文文,李甲等.蛋白聚糖诱导小鼠关节炎模型的研究进展[J].第二军医大学学报,2015,36(5):530-535.
12. J Keffer,et al.Transgenic mice expressing human tumour necrosis factor: a predictive genetic model of arthritis[J].EMBO J ,1991 Dec;10(13):4025-31.
13. Kouskoff V, et al. Organ-specific disease provoked by systemic autoimmunity[J]. Cell,1996,87(5):811-22.
14. A S Korganow,et al.From systemic T cell self-reactivity to organ-specific autoimmune disease via immunoglobulins[J].Immunity. 1999 Apr;10(4):451-61.