Caspase活性检测系列(分光光度法)检测原理及操作指南
Elabscience
一、检测原理
Caspase (Cysteine-requiring Aspartate Protease)是在细胞凋亡过程中起重要作用的蛋白酶家族。Caspase在正常状态下以酶原的形式存在于胞浆中,没有活性;在细胞发生凋亡阶段,Caspase被激活,活化的Caspase可裂解相应的胞浆胞核底物,最终导致细胞凋亡。
Caspase分光光度法检测试剂盒的原理是将Caspase序列特异性的多肽偶联至黄色发光基团pNA (p-nitroaniline)。当该底物被活化的Caspase剪切后,黄色发光基团pNA游离出来,可通过酶标仪或分光光度计(λ=405nm 或400nm)测定其吸光值,通过测定吸光度来检测Caspase的活性。
二、自备试剂
PBS、蛋白定量试剂盒(Bradford法,选用)
三、实验操作指南
1.准备工作:
A、 裂解液溶解后混匀,冰浴备用。
B、 裂解液工作液制备:每50 μL裂解液中加入0.5 μL DTT,冰浴备用。
2.样本处理:
A、悬浮细胞
1) 诱导完成后的细胞,2000 rpm离心5 min,弃上清,收集细胞,PBS轻轻重悬细胞并计数。
2) 2000 rpm离心5 min,弃上清。按照每200万细胞加入50 μL裂解液的比例加入预冷的裂解液工作液,重悬细胞。冰浴裂解30 min,期间涡旋震荡3~4次,每次10 s。
B、贴壁细胞
1) 按常规方法用胰酶消化贴壁细胞,收集细胞后2000 rpm离心5 min,弃上清。PBS轻轻重悬细胞并计数。
2) 2000 rpm离心5 min,弃上清。按照每200万细胞加入50 μL裂解液的比例加入预冷的裂解液工作液,重悬细胞。冰浴裂解30 min,期间涡旋震荡3~4次,每次10 s。
C、组织样本
1) 取50 mg组织置于培养皿中,手术剪剪碎,加入200 μL预冷的裂解液工作液,冰上用玻璃匀浆器匀浆 (组织量加倍时,加入的预冷裂解液也加倍)。
2) 将匀浆好的样本转移到1.5 mL的离心管中,冰浴放置5 min裂解。
3.12,000 rpm在4°C下离心10-15 min。
4.小心地吸取上清转移至新的EP管中,并置于冰上待用。
5.立即测定Caspase的酶活性或者-70°C保存样本,亦可取少量样本用Bradford法[E-BC-K168,详询当地经销商]测定蛋白浓度。
6.Caspase酶活性检测:
A、取Ac-特异性多肽-pNA和2 ×反应液,溶解后冰浴备用。
B、 2 ×反应液工作液制备:每50 μL 2 ×反应液加入0.5 μL DTT。
C、吸取45 μL含100-200 μg蛋白的细胞或者组织裂解上清,如体积不足45 μL则用裂解液工作液补足至45 μL(各组采用相同的蛋白含量和体系进行测定和比较)。
D、按照下表设置反应体系: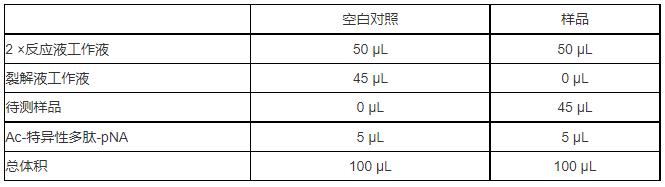
注意:
1) 在设置反应体系时先加入反应工作液,再加入待测样本后适当混匀,注意避免产生气泡。
2) 最后加入Ac-特异性多肽-pNA并混匀,注意避免气泡产生。
E、在加入Ac-特异性多肽-pNA混匀后,37℃孵育2~4 h。发现颜色变化较明显时即可测定OD405。如果颜色变化不明显可适当延长孵育时间,甚至可孵育过夜。
F、用酶标仪或分光光度计(100 μL比色皿)在λ=405 nm或400 nm测定样本吸光值。
G、通过计算OD样本值/OD阴性对照的倍数来确定凋亡诱导剂组Caspase 3的活化程度。
四、结果判断
Caspase的活性与AC-特异性多肽-pNA的分解量强弱成正比。
参考Chemicon公司的Caspase酶活力单位的定义:One unit is the amount of enzyme that will cleave 1.0 nmol of the colorimetric substrate Ac-peptide-pNA per hour at 37℃ under saturated substrate concentrations。即一个酶活力单位定义为当底物饱和时,在37℃一个小时可以剪切1 nmol Ac特异性多肽-pNA产生1 nmol pNA的Caspase的酶量。这样就可以计算出样品中含有多少个酶活力单位的Caspase。
说明:在本试剂盒的检测体系中,底物的起始浓度为0.2 mM,此时底物是饱和的,对于大部分样品而言,在37℃孵育4个小时以内底物都是饱和的;对于样品中Caspase酶活力特别高的情况,须用裂解液适当稀释样品后再进行测定。








