打破传统认知,降糖不仅依赖胰岛素!科学家发现,这种来自脂肪的激素也可以调节血糖……
丁香学术
导读
在我们进食时,富含能量的脂肪和葡萄糖会进入血液,正常情况下,它们会调动体内的胰岛素,然后胰岛素通常将这些营养物质输送到肌肉和脂肪组织的细胞中供能或者被储存起来以备后用。
100 年前,胰岛素的发现为数百万糖尿病患者打开了一扇通向生活和希望的大门,从那时起,胰腺产生的胰岛素就被认为是治疗糖尿病的主要手段。
然而,对于有胰岛素抵抗的人(如 2 型糖尿病患者,其特征是慢性高血糖和血脂异常)来说,胰岛素无法发挥抑制肝内葡萄糖生成(Hepatic Glucose Production, HGP)和脂肪分解的功能。因此,葡萄糖并不能被从血液中有效去除;此外,不受调节的脂肪分解导致游离脂肪酸(FFAs)在肝脏、肌肉和胰岛等外周代谢组织中异常积累,而且这些额外的脂肪酸还会加速肝脏的葡萄糖生成,使得原本已经很高的葡萄糖水平更加复杂。
前期的研究发现,成纤维细胞生长因子 1(FGF1)在适应性脂肪重塑中发挥重要的作用,能够适当地改造脂肪组织。此外,FGF1 还以 FGF 受体 1(FGFR1)依赖的方式快速降低糖尿病小鼠模型的血糖水平,然而,其根本的机制尚不清楚。
2022 年 1 月 4 日,美国加州萨尔克生物研究所的研究团队在 Cell Metabolism 发表了题为 FGF1 and insulin control lipolysis by convergent pathways 的研究性文章,他们发现,FGF1 可以像胰岛素一样,通过抑制脂肪分解来控制血糖,但这两种激素的作用方式是不同的。FGF1 抑制脂肪分解是通过脂肪组织中 PDE4D 的激活介导的,同时 FGF1 的抗脂解活性对于急性降糖也是必需的。
图片来源:Cell Metabolism
主要研究内容
FGF1 以一种依赖于脂肪 FGFR1 的方式抑制脂肪分解
首先,为了验证 FGF1 诱导的血糖降低依赖于 FGFR1 在脂肪组织中的表达,他们构建了在在成熟脂肪细胞中特异性缺失 FGFR1 的小鼠模型 adR1KO。结果发现 FGF1 能够有效减低 WT 小鼠中的血糖水平,但是在 adR1KO 小鼠中无作用。考虑到 adR1KO 小鼠胰岛素水平的升高,以及肝脏葡萄糖生成(HGP)与脂肪分解之间的联系,他们推测 FGF1 可能影响了脂肪分解。
为了探究这一假想,他们首先构建了 FGF1 敲除小鼠(F1KO),发现在没有胰岛素补偿的情况下,体外脂肪分解实验显示 F1KO 小鼠的脂肪分解显著升高。此外,FGF1 对基底和异丙肾上腺素(ISO)诱导的脂解有明显的抑制作用。同样,FGF1 还以剂量依赖的方式抑制了 3T3-L1 脂肪细胞中同种异体诱导的脂肪分解。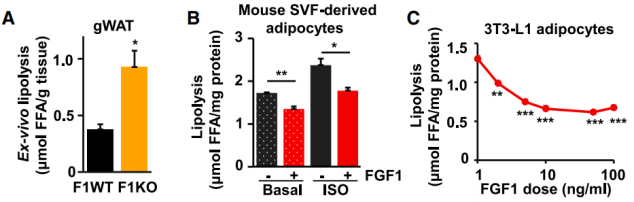
图片来源:Cell Metabolism
随后,为了确定外源性 FGF1 是否能类似地影响体内脂肪脂解,他们对 adR1WT 和 adR1KO 小鼠给予外源 FGF1。之后他们发现,FGF1 降低了 adR1WT 小鼠血清 FFA 水平约 30%,但对 adR1KO 小鼠无影响。
放射标记的油酸是体内脂肪分解的一种测量方法,他们的实验发现,在 FGF1 处理的 adR1WT 小鼠中,油酸的转换率降低,表明基础脂解降低。相比之下,FGF1 预处理对 adR1KO 小鼠的油酸转换率没有影响。因此,上述的发现表明 FGF1-FGFR1 信号通路是一种调节脂肪分解的新途径。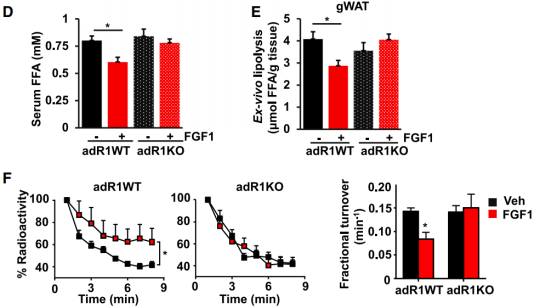
图片来源:Cell Metabolism
FGF1 调节体内肝脏葡萄糖生成
胰岛素在一定程度上通过抑制脂解从而抑制肝脏葡萄糖生成(HGP)来调节血糖水平,而 HGP 的异常调节会导致胰岛素抵抗中的高血糖。接下来,为了确定 FGF1 是否通过抑制脂肪分解而显著降低了 HGP,他们首先测量了 FGF1 影响糖异生底物利用的能力。他们发现,经 FGF1 预处理的小鼠从丙酮酸合成葡萄糖的能力显著降低;此外,FGF1 抑制丙酮酸利用的能力依赖于脂肪细胞 FGFR1 的表达。
为了进一步解析其中的详细代谢过程,他们在注射 FGF1 后 2 小时用质谱法测定小鼠肝脏中糖异生中间体的水平。结果发现,在注射 FGF1 的小鼠中,丙酮酸下游的中间产物包括葡萄糖 6-磷酸(G6P)、果糖 6-磷酸(F6P)、磷酸甘油酸(PG)、磷酸烯醇式丙酮酸(PEP)和草酰乙酸(OAA)显著降低,而参与三羧酸循环(TCA)的代谢物则没有受到影响。不过,这些糖异生底物的显著减少在 adR1KO 小鼠中并不存在,因此 FGF1 调节 HGP 也是需要 FGF1 受体的存在。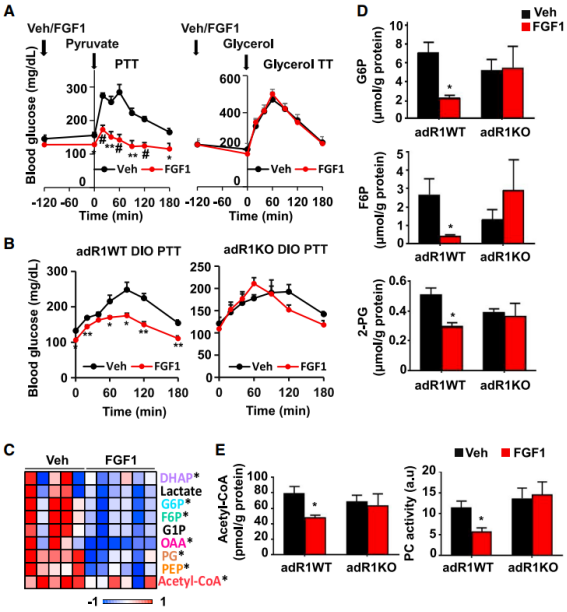
图片来源:Cell Metabolism
体内 FGF1 诱导的血糖降低依赖于 PDE4
胰岛素依赖 PI3K 通路激活 PDE3B 来抑制脂肪分解,FGFR1 的激活也可以通过 PI3K 通路发出信号,但有趣的是,PDE3B 的抑制并不影响 FGFR1 诱导的脂肪分解抑制;相比之下,FGF1 的抗脂解活性却能够被 PDE4 选择性抑制剂阻断。
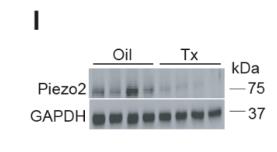
这一新型的作用机制是否也有助于胰岛素抵抗小鼠血糖稳态的维持?为了探究这一概念,研究人员用 PDE4 抑制剂罗氟司特在肥胖小鼠中进行了实验。在这些小鼠中,罗氟司特会瞬间升高血糖、血清 FFA 和胰岛素水平。值得注意的是,氟明司特预处理后,FGF1 降低血糖水平的能力丧失了。这些数据支持在 FGF1 的降糖作用中需要依赖 PDE4 的脂解调节。
前期有报道 PDE4D 在体内具有调节脂肪分解的能力,因此他们接下来也探索了 PDE4D 在 FGF1 代谢作用中的作用。他们惊喜地发现,在稳态和 ISO 刺激下,PDE4DKO 小鼠的脂肪分解显著较高,但其对 FGF1 的处理则不敏感。更重要的是,FGF1 并不能降低这些高脂肪喂养 PDE4DKO 小鼠的血糖。这些数据表明,脂肪 PDE4D 是外源性 FGF1 降糖作用所必需的。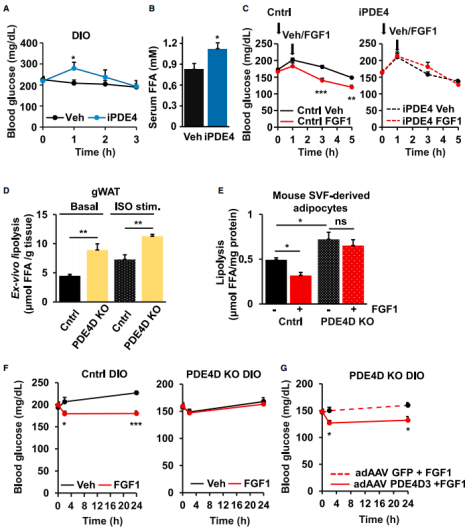
图片来源:Cell Metabolism
FGF1 诱导 PDE4D 调控位点的磷酸化
磷酸二酯酶的活性受多种磷酸化事件的调控,这些磷酸化事件整合了不同的信号通路。为了探究 FGF1 信号通路是否诱导 PDE4D 的磷酸化,他们用 FGF1 处理 ISO 刺激的脂肪细胞,FGF1 的共同处理增加了 PDE4D 磷酸化的程度和持续时间。
进一步的研究发现,PDE4D 蛋白上游保守区的 S85 位点以及位于 N 端的 PDE4D 特异性位点 S44 被 PKA 磷酸化。
为了研究 PDE4D 磷酸化在脂解调节中的作用,他们构建了这些位点突变为丙氨酸的 adAAV 表达载体。结果发现,S44 位点突变破坏了 PDE4D 脂质分解和磷酸化的能力。与这些发现一致的是,在 PDE4 抑制缺失的情况下,S44 突变体中 ISO 诱导的磷酸化水平都有所降低,这意味着 S44 磷酸化的调节作用。以上数据表明 S44 位点的特异性磷酸化是 FGF1/ PDE4D 通路脂解活性所必需的。
图片来源:Cell Metabolism
结语与拓展阅读
脂肪组织拥有身体 80%-85% 的能量储备,脂肪储存或释放是决定生理稳态的核心。然而,虽然脂肪脂解是由多种因素触发的,但胰岛素是目前已知的唯一的抗脂解调节剂。
在这项研究中,他们报道了 FGF1 诱导的信号级联,可作为一种替代的脂肪分解抑制途径,并建立了 FGF1 作为脂肪酸稳态和血糖稳态的调节器。
早在 2012 年,该研究团队就在 Nature 发文确定了 FGF1 作为脂肪重塑的重要媒介,他们发现,FGF1 在脂肪组织中对高脂肪饮食的反应是敏感的且呈现反应性升高,而缺乏 FGF1 的小鼠在高脂肪饮食下则发展出一种糖尿病表型,并伴随着异常的脂肪膨胀。
对 FGF1 缺陷小鼠脂肪储存的进一步分析显示,血管系统网络中存在多种组织病理,比如炎症反应加重,脂肪细胞大小分布异常,胰腺脂肪酶异位表达等,以此鉴定了 FGF1 轴是维持代谢稳态和胰岛素敏感性的关键。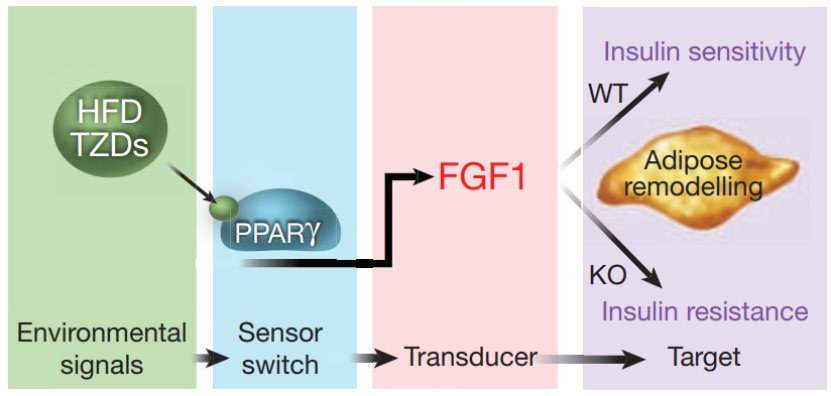
图片来源:Nature
在随后的功能恢复研究中,他们发现 FGF1 以脂肪依赖性的方式快速使糖尿病小鼠模型的血糖水平正常化,并于 2014 年以题为 Endocrinization of FGF1 produces a neomorphic and potent insulin sensitizer 发表于 Nature 杂志。
图片来源:Nature
在最新的这项研究中,通过探索这些抗糖尿病活性的内在机制,他们发现了 FGF1-FGFR1 信号通路,它类似于胰岛素信号通路,通过抑制脂肪分解降低血糖水平,从而通过调节丙酮酸羧化酶的变构降低体内的 HGP。
此外,与胰岛素-PDE3B 轴在脂肪细胞内的作用机制不同,FGF1 参与一个交替的 PI3K/PDE4D 通路来抑制 cAMP-PKA 轴,cAMP 的减少进而抑制了 PKA 介导的磷酸化及其随后的脂肪分解。
图片来源:Cell Metabolism
本研究主要通讯作者 Ronald M. Evans 教授说到:「发现另一种抑制脂肪分解和降低葡萄糖的激素是一个领域内的突破性进展,我们发现的这个调节脂肪分解的新成员,将帮助我们了解能量存储在体内是如何被管理的。」
另一通讯作者 Michael Downes 提到:「FGF1 在胰岛素抵抗性糖尿病小鼠中诱导持续血糖下降的独特能力,是一种很有前途的糖尿病患者治疗途径。我们希望对这一途径的深入研究将为糖尿病患者带来更好的治疗策略。」