WB 样品粘稠像「鼻涕」怎么办?
英文特
「救命!做 WB 蛋白样品提取时,样品加入裂解液,离心后发现管里有很多的胶状物,非常粘稠,有点像鼻涕!多加裂解液稀释一下仍然没有效果,蛋白浓度还变得很低。不死心的我把它戳出来玩了一会,戳戳戳仍然是一大团,这粘稠物是什么?对我的后续实验会有什么影响?」
当你看到这团粘稠的「鼻涕」,就意味着你即将经历下面五个难题的考验:
1. 样品吸液困难
堵塞移液器:离心后吸上清液的时候胶状物会堵塞移液器头,移液后上清液所剩无几。
无法分离上清液:样品太过粘稠,移液吸取时会整体带出,无法分离上清液。
2. 定量困难
无法测定及定量:样品粘稠无法成为均一液体,导致蛋白定量 OD 值 out,无法进行定量测定。
3. 样品很难进入胶孔
上样困难:尽管加了 loading 进行煮样,上样样品仍然特别粘稠,很难加入到胶孔。
4. 样品很难跑出孔发生拖带
电泳结果不佳:SDS-PAGE 时粘稠样品会卡在点样孔里,条带不成直线,有很严重拖尾,条带不集中。
5. 粘稠的样品通常无法获得好结果
蛋白丢失:粘稠物包裹蛋白导致无法释放,样品很难跑出理想的结果,有时甚至是完全没有条带。
令人反感的粘稠「鼻涕」是怎么形成的?
问题出在细胞裂解过程中,细胞中的 DNA 缠绕其他大分子物质,导致蛋白质聚集,再加上其他细胞碎片(如油脂、难溶蛋白等)共同形成粘稠的「鼻涕」状态,也被称为「核酸残团」。
核酸残团的存在大大降低了蛋白的提取效率,使得蛋白丢失,从而导致了 WB 实验中的一系列问题。曾有研究者用不同方法进行小鼠脾脏和肝脏蛋白提取得到蛋白质图谱[1]:
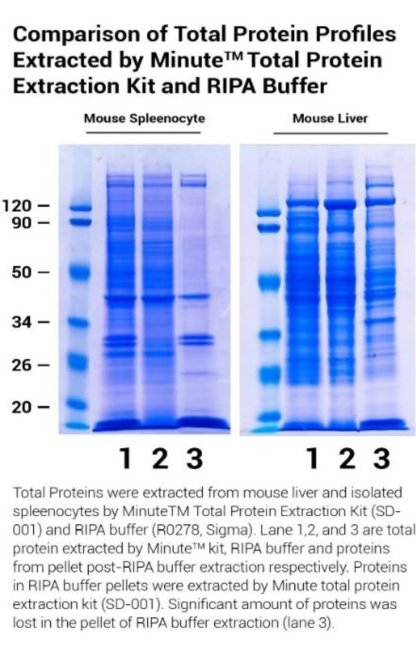
图 1:从小鼠脾脏和肝脏中使用不同方法提取总蛋白的蛋白图谱
条带 1 为柱式法提取的蛋白样品,条带 2 为 RIPA 可溶组分(RIPA 裂解后的上清),条带 3 为 RIPA 不可溶性组分(丢弃的沉淀部分)。实验发现 RIPA 的不可溶组分蛋白质图谱与可溶性组分图谱相似,但是不完全相同。
丢弃的不可溶组分中仍然可检测到许多蛋白条带,覆盖了整个蛋白质图谱分子量范围,不同样品的不可溶组分图谱也各不相同。丢失的蛋白会引起蛋白图谱发生变化,改变不同种类蛋白的比例,且具有随机性和不可预测性,无法真实的体现样品中蛋白的表达情况。
除以上问题外,核酸残团的存在还会导致 WB 内参蛋白跑不齐、磷酸化蛋白难以检测或趋势不正确,WB 背景高等众多问题。所以想得到真实的 WB 结果,必须要在样品制备过程中去除这些粘稠物。
如何踢开样品制备中的这块「绊脚石」?
1. 超声破碎
超声波的能量可以破坏蛋白复合物,切割染色质,从而改善样品粘稠状态。但该方法存在一些弊端,如:
1)经过超声波的处理,样品会产生很多泡沫,影响蛋白浓度测定及后续实验;
2)超声过程产生的热量,会导致蛋白质变性或者降解。如做蛋白的磷酸化研究尽量避免使用该方法;
3)需要反复清洗探头可能产生样品间的交叉污染;
4)裂解液体系较小的样品,损失较多不适宜直接利用探头超声;
5)无法达到将蛋白与核酸完全分离的效果。
2. 使用核酸酶降解核酸
核酸酶可将蛋白样品中的核酸降解,改善样品粘稠状态。但核酸酶无法水解紧密的核染色质,且裂解液中含有的表面活性剂和盐等成分会抑制核酸酶对核酸的降解效率,无法起到最佳效果。
3. 推荐优选柱式法进行蛋白样品提取
解决蛋白样品粘稠的最佳方式是改变蛋白质的制备方式,可以选择新一代柱式蛋白提取法替代传统的裂解液法。柱式法通过使用优化的裂解液配方,可有效提高裂解液对样品的裂解效率,特别是可以提升难溶蛋白的溶解效率。同时配合使用离心管柱技术有效阻截核酸,让蛋白溶液瞬间澄清无粘稠物产生,无需复杂操作,即可获得高质量无丢失的蛋白样品。
测试实例:裂解液法 VS 柱式法
同种样品分别使用裂解液法和柱式法进行 WB 样品制备,SDS-PAGE 电泳后考染如图 2,左条带为使用普通强裂解液提取的蛋白样品,右条带为柱式法提取的蛋白样品,可见使用柱式法法提取的样品胶孔中可明显改善样品滞留、拖带的情况发生。
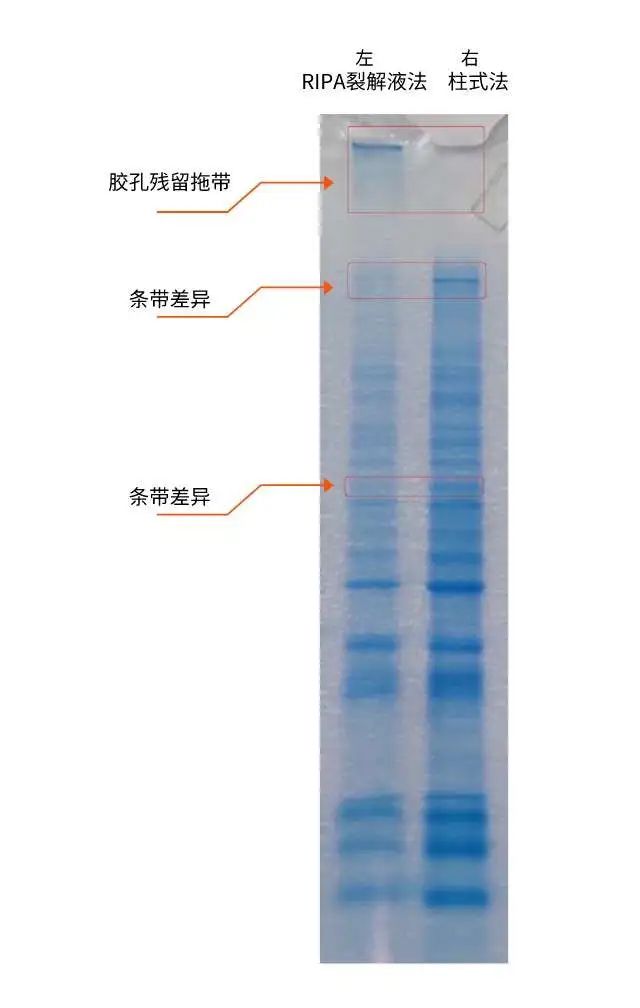
图片来源:英文特
WB 蛋白样品制备过程中出现样品粘稠的情况并不代表样品提取失败,而是样品裂解较为充分的表现,但是如果放任不管则会引发一系列连锁效应,最终导致 WB 实验失败。选择合适的方法进行处理。成功获得高质量的蛋白样品,是 WB 实验成功必不可少的因素,千万勿忽略!