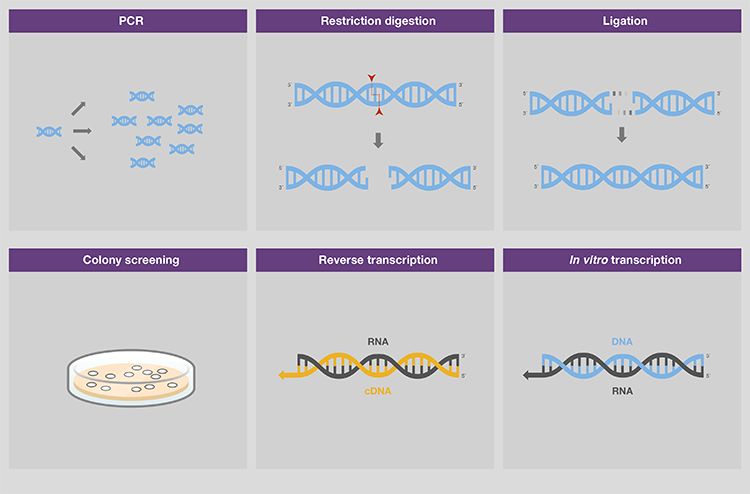
核酸电泳工作流程——5 大主要步骤
赛默飞世尔科技
凝胶电泳是许多分子生物学实验的重要部分。建立核酸电泳需采取一系列步骤来实现核酸样品的最佳分离和分析。
核酸凝胶电泳工作流程
1、选择和制备凝胶
琼脂糖和聚丙烯酰胺是核酸分离中最常用的两种凝胶基质。两种材料都是三维基质,孔径大小适合核酸分离,且与样品间无反应。可通过改变基质的百分比来调整孔径大小,从而有效分离不同大小的核酸。
有关琼脂糖凝胶和聚丙烯酰胺之间的选择,主要取决于核酸样品的大小和所希望达到的分辨率,虽然凝胶灌制和样品回收的方法也可考虑(表 1)。琼脂糖凝胶的孔径大小非常理想,可分离 0.1-25 kb 范围内的核酸分子。聚丙烯酰胺形成的孔径较小,可用于分离小于1 kb 的核酸分子。某些情况下,可采用聚丙烯酰胺凝胶以获得片段小于 100 bp 的单碱基分辨率[1]。
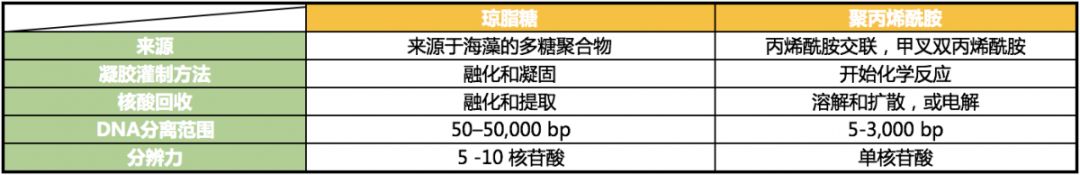 表 1. 琼脂糖凝胶和聚丙烯酰胺凝胶之间的差异
表 1. 琼脂糖凝胶和聚丙烯酰胺凝胶之间的差异
2. 准备标准品和样品
a .核酸标准品选择
当运行凝胶时,含有已知大小的核酸参照样品通常被称为标准品、标记或分子量标准,用于目的样品大小的估计。在为给定样品选择合适的分子量标准时,需考虑如下因素:
- Ladde 类型(例如 DNA 或 RNA),片段结构(例如单链或双链),构象(例如超螺旋、开环或线性)以确保对迁移进行适当比较(了解更多: 结构和构象对样品迁移性的影响)
- 片段的数量和适当的分离形式,用于大小的估计
- 预期用途,如分子量标准是设计用于定性分析还是精确的定量测定
- 不同类型凝胶适用的分子量标准(例如,部分预制凝胶推荐设计特定分子量标准以获得最佳运行结果)
- 上样染料的性质,避免目的条带模糊(图 1)
- 上样缓冲液与使用凝胶的兼容性(例如,缓冲液的盐浓度会影响样品的迁移)
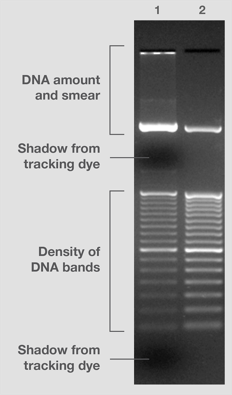 图 1. DNA 分子量标准差异。 分子量标准 #2 由色谱纯化的 DNA 片段组成,存在于上佳的上样缓冲液中,可产生相等或预期强度的条带,并且不含有条带污点,无染色阴影。与此相反,分子量标准 #1 采用较老技术制造,并存在于次优组分的缓冲液中。
图 1. DNA 分子量标准差异。 分子量标准 #2 由色谱纯化的 DNA 片段组成,存在于上佳的上样缓冲液中,可产生相等或预期强度的条带,并且不含有条带污点,无染色阴影。与此相反,分子量标准 #1 采用较老技术制造,并存在于次优组分的缓冲液中。
b. 样品和标准品准备
须计算上样到凝胶中的 DNA 量,以确保目的条带良好分离,并用于可视化和检测。虽然用荧光染料足以检测 1 - 100 ng/条带的 DNA,但最小可检测量取决于 所用染料(了解更多: 核酸染色特性)[2]。注意,样品或标准品的超载会造成条带污点并遮盖附近条带,从而导致条带分辨不清,特别是片段大小相似时(图 2A)。
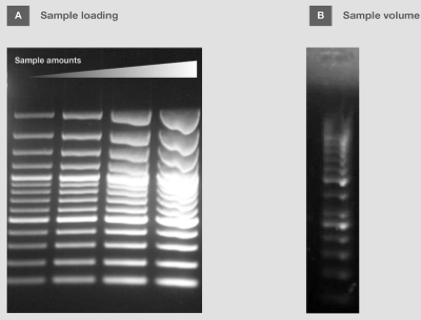 图 2. 次优样品分离。(A) 负载影响条带分辨率。 (B) 上样量过低会导致条带扭曲。
图 2. 次优样品分离。(A) 负载影响条带分辨率。 (B) 上样量过低会导致条带扭曲。
在上样缓冲液中准备好样品和分子量标准,其最终的体积通常占胶孔体积的 30%。由于孔底分布不均匀(图 2B),使用较少的上样体积会导致条带扭曲。对于含有 DNA 结合蛋白或粘性末端的样品,凝胶上样之前,混合物需加入至 含有 SDS 的上样染料中一同加热,因为蛋白质结合以及 DNA 片段之间的相互作用会导致分离效果不佳。
c .上样染料和缓冲液选择
制备凝胶电泳时,样品中添加了凝胶上样缓冲液 (通常是 6X 或 10X 的原液)。上样缓冲液包括如下组分:
- 密度成分,如甘油或蔗糖,增加样品粘度,确保样品沉入孔中。
- 盐,如 Tris-HCl,为样品创造良好的离子强度和 pH 值环境。高盐浓度的上样缓冲液会产生更大片或扭曲的条带以及污点。
- 金属螯合剂,如 EDTA,可阻止样品中的核酸酶降解核酸。
- 染料 为监测样品的上样、电泳进展和 pH 值变化提供了颜色指示。部分上样缓冲液可能包含多个染料,以便有效跟踪样品中不同大小分子的迁移。
通常,上样染料都是带负电荷的小分子,因此迁移方向与核酸相同。其中有的显示pH值颜色,上样和运行时可作为样品的pH 指示剂(图 3A)。常用染料包括溴酚蓝、二甲苯青、苯酚红、和橙色 G。选择上样缓冲液时,需注意染料的表面迁移(s)(图 3B, 表 5 和 6)以避免遮盖目的核酸条带,特别是分子大小接近时(图 3C)。染料遮盖会影响目的条带的分析和量化,导致结果不可靠。
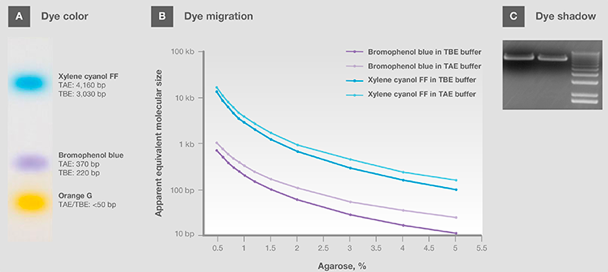 图 3. 中性pH中染料颜色。(B)在 TAE 和 TBE 缓冲液中不同百分比琼脂糖里的染料迁移。(C)在可视化过程中染料阴影遮盖条带。
图 3. 中性pH中染料颜色。(B)在 TAE 和 TBE 缓冲液中不同百分比琼脂糖里的染料迁移。(C)在可视化过程中染料阴影遮盖条带。
3. 运行电泳
在凝胶、标准品和样品制备后,进行电泳。拆卸梳子和添加电泳缓冲液前,凝胶须完全凝固。凝胶梳应平稳地向上提起,以免撕裂凝胶、扭曲胶孔。移除梳子和添加缓冲液后,注意清除孔里的气泡。对于聚丙烯酰胺凝胶,应用缓冲液彻底冲洗胶孔,以清除残留未聚合的丙烯酰胺。
水平凝胶应朝向凝胶盒 ,样品孔位于负极一侧,以便在电泳启动后,将样品移动至正电极侧(图 4A)。该方向可记为“跑向红色”,因为正电极通常为红色。垂直凝胶盒中,胶孔设计在顶部(图 4B)。
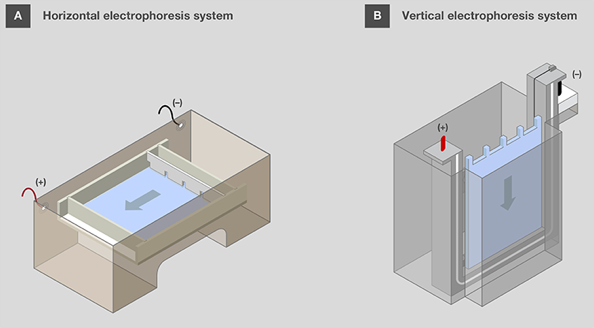 图 4. 水平和垂直电泳系统的凝胶装置。 箭头表示电泳中核酸迁移的方向。
图 4. 水平和垂直电泳系统的凝胶装置。 箭头表示电泳中核酸迁移的方向。
4. 在凝胶中可视化样品
凝胶运行完成后,需对样品进行可视化分析。由于普通照明环境下,核酸不可见,因此需要一种可视化的检测方法。如表 2所述,可用方法在样品检测中,提供了不同的灵敏度和增益范围[2]。
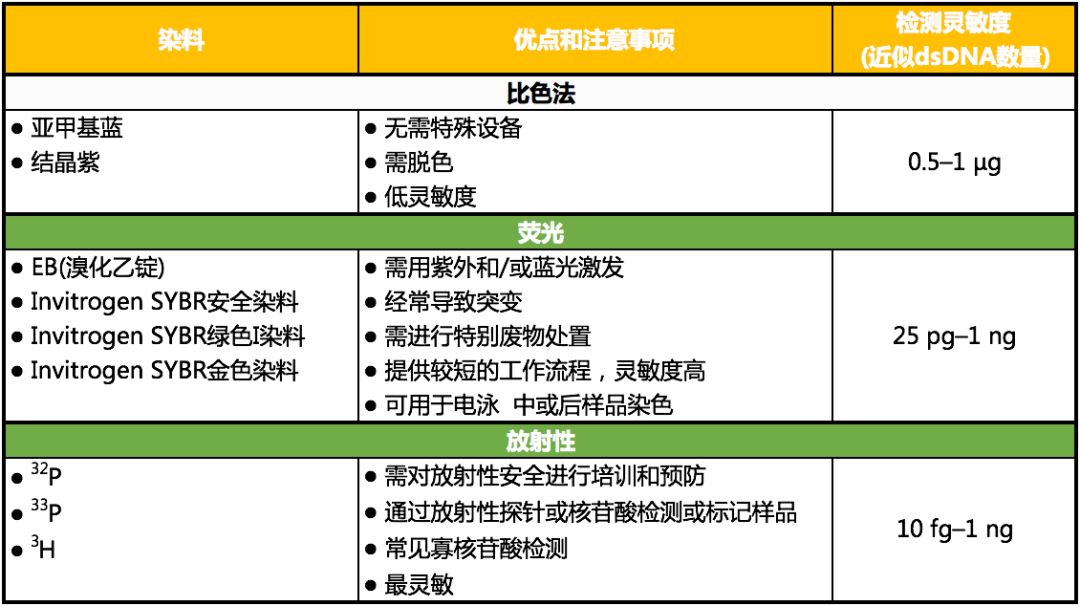 表 2. 常见核酸凝胶染色和检测方法
表 2. 常见核酸凝胶染色和检测方法
5. 记录凝胶
a. 荧光成像技术
可视化后,核酸凝胶通常被存档记录下来,用于记录和分析电泳结果。如果样品被荧光染料染色,需特殊设备以适当的光源激发染料,使其显象并捕捉凝胶图像。激发光源在凝胶上,称为反射照明器(类似于手持式紫外线灯),或在凝胶下,称为透射仪 (图 5)。由于反射照明器上的光源位置较远,所以样品收到的能量较少。这样可以减少紫外线对核酸的损害,但也会降低凝胶条带的信号。另一方面,透射仪器可为条带提供更高的信号,但由于辐射接近凝胶,会增加紫外线造成的伤害。
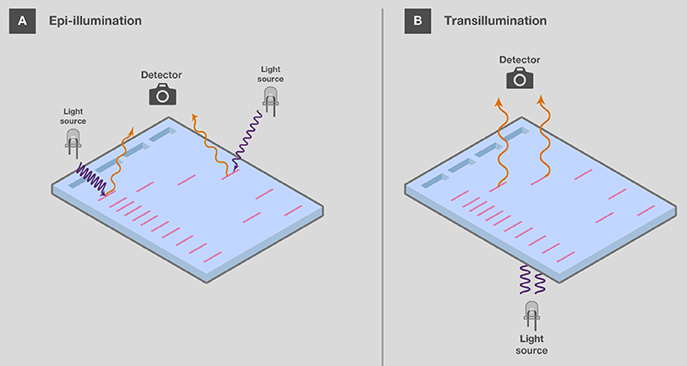 图 5. 反射照明器和透射仪
图 5. 反射照明器和透射仪
b. 放射自显影法
在放射性核酸的电泳过程中,凝胶电泳后会暴露在 x 射线胶片上,这一过程即称为放射自显影法。条带辐射的强度可用光密度测定来定量。
参考文献
1.Stellwagen NC (1998) DNA Gel Electrophoresis. In: Tietz D (editor), Nucleic Acid Electrophoresis (Springer Lab Manual). Heidelberg: Springer. pp 1–53.
2.Thermo Fisher Scientific Inc (2010) Nucleic Acid Detection and Analysis. In: Molecular Probes Handbook: A Guide to Fluorescent Probes and Labeling Technologies. pp 349–360.
文章来源:赛默飞世尔科技