要想荧光定量 PCR 结果好,这些实验设置要点需记牢
赛默飞
实时荧光定量 PCR 技术(Quantitative Real-time PCR,简称 qPCR)是在 PCR 扩增过程中,通过实时监测荧光信号的变化,达到对待检测样本中初始模板定量分析的方法。当前 qPCR 技术被广泛应用于临床疾病诊断,动物疾病监测,食品安全分析等领域。随着 2020 年新冠疫情在全球的蔓延,qPCR 技术更是因其检测通量高,速度快,操作简便等优势成为新冠病毒核酸检测的有效方法被众人所熟知。
那么为了得到可靠、准确的检测结果,我们需要注意哪些方面呢?其实决定一次实验成功的因素有很多,从样本的质量,引物探针的设计,再到 PCR 反应体系中各组分的比例优化等。当我们准备好了这些,在上机检测时又要根据实验目的正确完成程序设置,才能最终得到良好的实验结果。那么今天我们就从荧光定量 PCR 软件程序设置入手来介绍一下这其中需要注意的一些方面。
Part 1:规范正确的新建实验方式
当我们准备好样品开始进行上机测试时,第一步就是新建实验。此时我们可以通过点击 Advanced Setup(图 1A,图中红框)或 Create New Experiment(图 1B,图中红框)的方式创建一个新的实验,也可以通过点击 Template 按钮导入已经保存好的实验程序文件(.edt 模板文件)快速开始反应(图 1,图中绿框)。
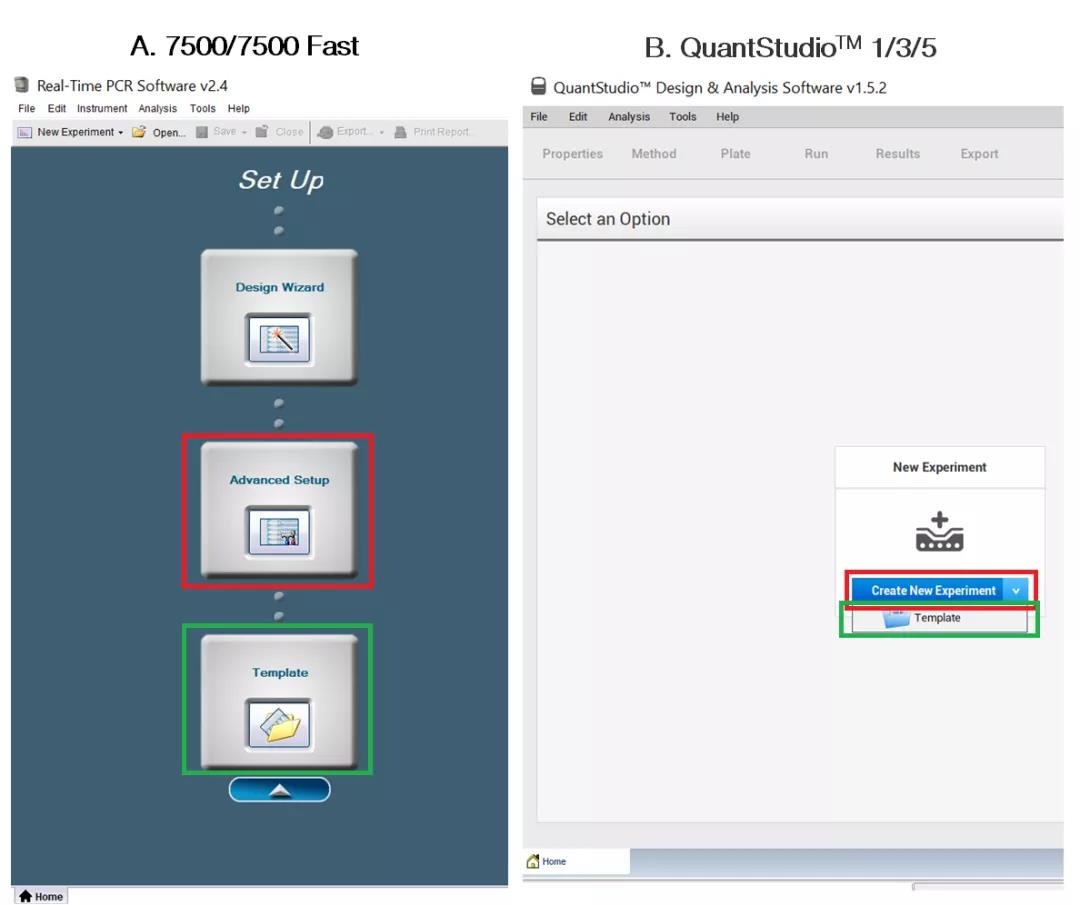 图 1 新建实验的方法
图 1 新建实验的方法
导入 Template 文件的方式简单快捷,但是我们注意到有时大家会通过直接双击 edt 模板文件的方式打开已保存的模板文件,这种不正确的导入方式可能会引起软件 JAVA 报错从而导致实验中断(图 2)。那么规范的模板导入方式应该是怎样的呢?以 7500 仪器和 QuantStudio™ 1/3/5 仪器对应分析软件为例,我们只需先将软件打开,通过主界面的 Template 按钮导入 edt 模板文件即可(图 1,绿色方框),该方法既能节省时间又可以保证实验运行正常。
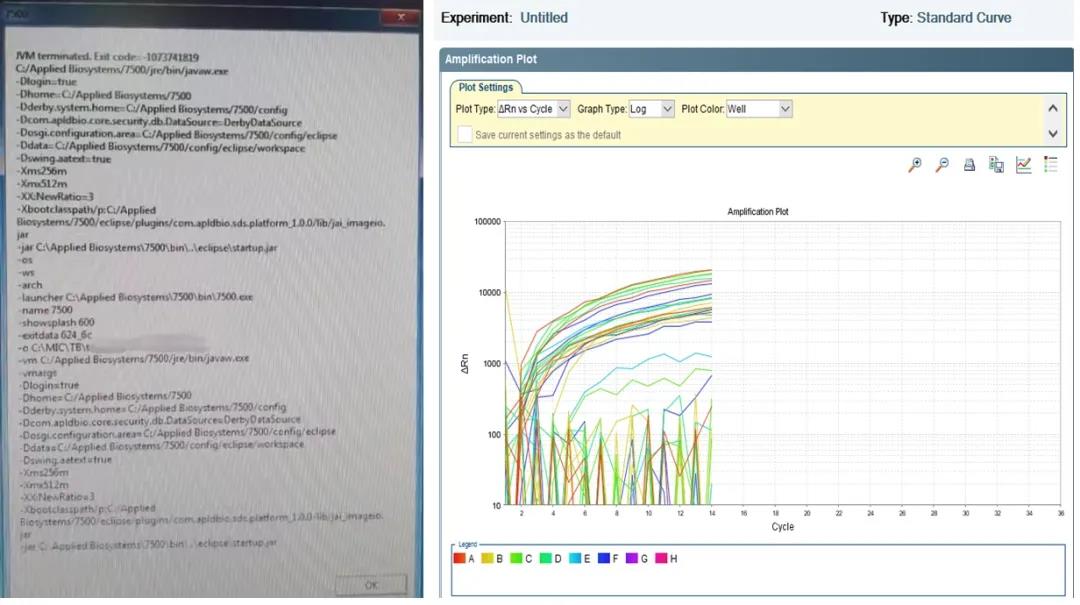 图 2 双击 edt 模板文件运行实验导致 JAVA 报错实验中断
图 2 双击 edt 模板文件运行实验导致 JAVA 报错实验中断
Part 2:Experiment Properties 的选择
当我们选择新建一个实验时,第一步需要完成 Experiment Properties 的设置。在这里我们为所运行的实验设置实验名,根据实验目的确定实验类型,基于所用荧光标记策略选择荧光定量方法是探针法还是染料法等。而在这里小编经常会被问到的一个问题就是最后一项运行模式该如何选择,Standard Mode 和 Fast Mode 适用的场景是什么,导致二者运行时间差异如此之大的原因是什么?(图 3)
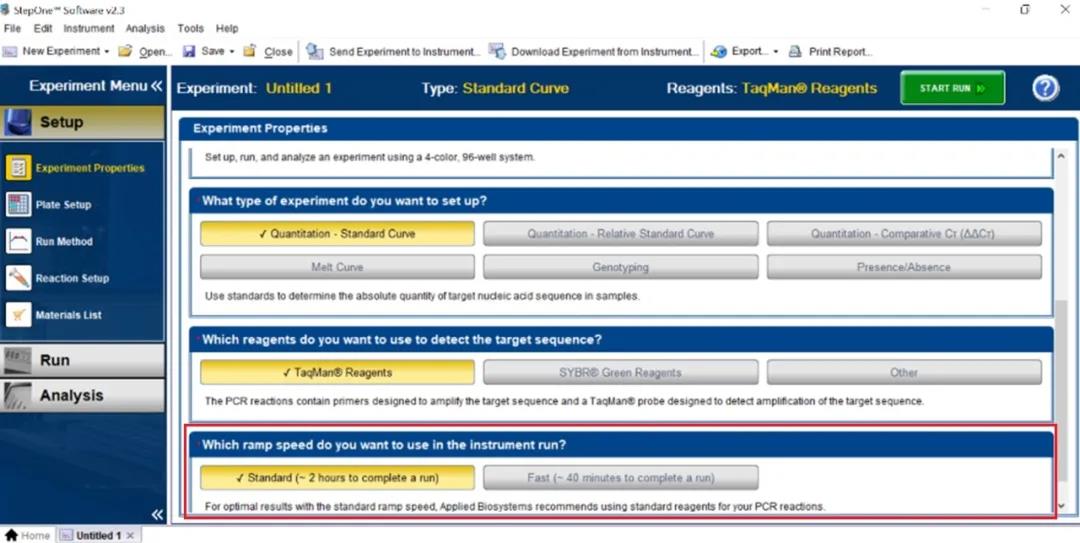 图 3 StepOne software v2.3 Experiment Properties 设置页面
图 3 StepOne software v2.3 Experiment Properties 设置页面
其实决定是否可以选择 Fast Mode 来进行反应的先决条件有两个:第一,仪器可以支持快速反应,例如 7500 Fast 就可以进行快速反应而 7500 不行。第二,我们所选用的试剂可以用于快速反应。只有满足这两个条件我们才可以选择快速反应模式。而 Standard Mode 和 Fast Mode 的主要区别在于不同模式下仪器升降温速率不同,快速模式下升降温速度更快。下图列举了当前部分用于基因表达和基因分型的 Master Mix 所支持的反应模式,供大家参考(图 4)。另外针对当前使用较为广泛的体外诊断试剂盒,如新冠检测试剂盒,大家在运行模式选择时需要根据试剂盒说明书做相应的设置,保证实验设置与试剂盒说明书一致。
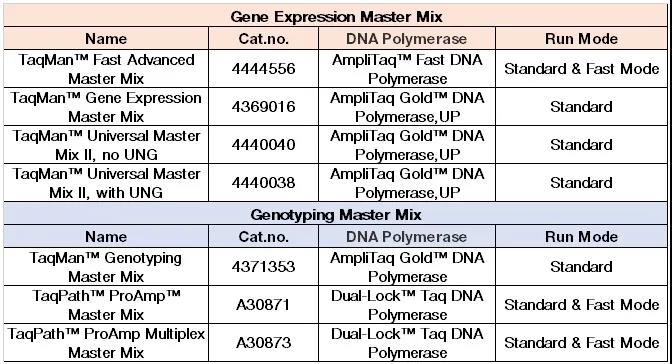 图 4 常见基因表达和基因分型 master mix 支持反应模式整理表
图 4 常见基因表达和基因分型 master mix 支持反应模式整理表
Part 3:Plate Setup 设置布板信息
完成了 Experiment Properties 的设置后就进入了 Plate Setup 布板页面,此时我们需要分别进行 Define Targets and Samples 步骤去定义我们待检测 Target 的荧光标记策略和样本信息,以及 Assign Targets and Samples 步骤来完成对样品及待检测目标具体孔位分布信息的注释。
其中定义 Target 时,如果我们选择的是染料法,那么 Reporter 下选择 SYBR 而 Quencher 下选择 None。如果我们采用的是探针法则根据自己探针设计情况选择对应的 Reporter 和 Quencher,这里需要着重注意的是在进行探针设计时一定要选择所使用仪器上已完成光谱校准的染料来标记探针,这样我们得到的结果才是准确可靠的。
另外当我们选择的实验类型是相对定量时,如果我们希望软件自动生成相对表达的分析结果柱状图的话还需要在 Assign Targets and Samples 页面对待检测目标及样本进行更详尽的注释,如在下图页面中的 Assign target(s) to the selected wells 下定义正确的 Task 类型,Select relative quantitation settings 处设置正确的内参基因和对照样本等(图 5)。
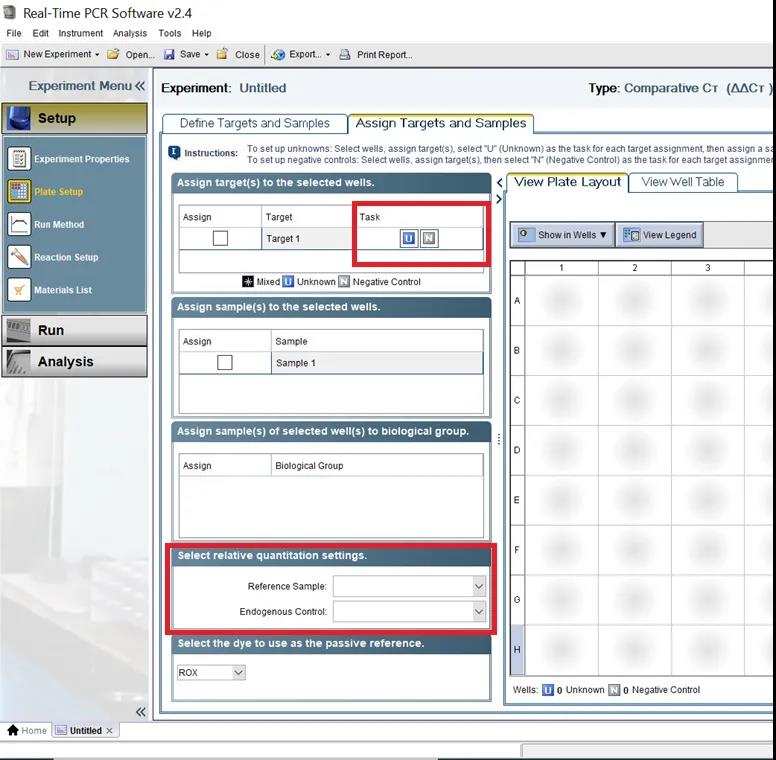 图 5 Real-Time PCR Software v2.4 软件 Assign Targets and Samples 页面
图 5 Real-Time PCR Software v2.4 软件 Assign Targets and Samples 页面
而不正确的设置将会导致相对表达数据分析错误或不显示。如图 6 的实验设置中就是因为在定义内参基因 ACTIN 时错误的将其 Task 类型选为了 N,即 Negative Control,而在 Select relative quantitation settings 下又将 ACTIN 设置为内参基因,这样相矛盾的设置导致最后结果分析中的 Gene Expression plot 不显示(图 6A),ACTIN 的 Task 类型更改为 U,也就是 Unknown 后重新分析实验即可得到正确的结果(图 6B)。
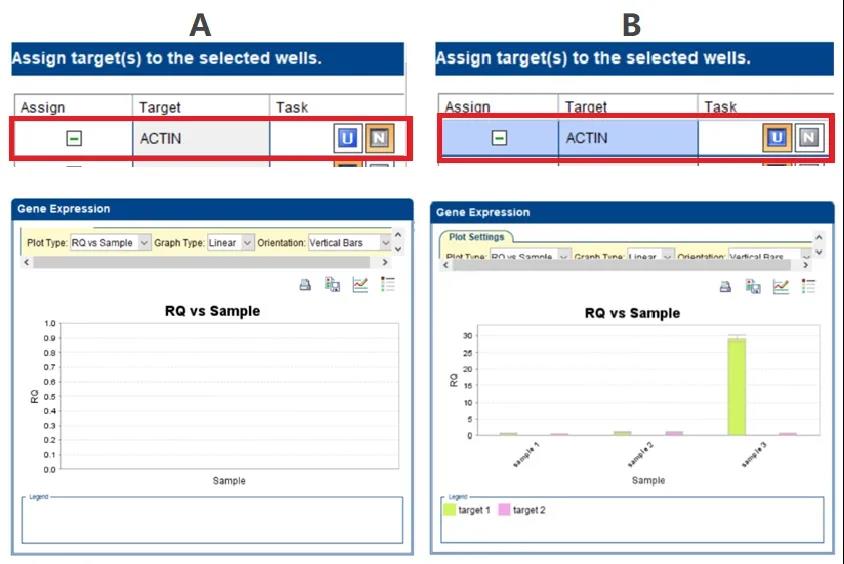 图 6 内参基因 Task 类型选择错误导致 Gene Expression 图谱不显示
图 6 内参基因 Task 类型选择错误导致 Gene Expression 图谱不显示
在 Assign Targets and Samples 设置页面的最后一项是 Select the dye to use as the passive reference,也就是设置我们反应体系是否含有参比荧光。这里需要根据实际情况进行选择,不正确的定义参比荧光同样会导致最终结果的异常。例如图 7 中实验采用染料法进行相对定量分析,但是结果中的扩增曲线异常(图 7A),排查多组分图时发现 SYBR 在扩增循环过程中荧光信号变化正常,但是细致来看作为参比荧光的 ROX 信号却在整个反应过程中信号接近于零(图 7B)。我们知道扩增图谱纵坐标 ΔRn 的数值是报告基团荧光信号和参比荧光信号的比值,当 ROX 的荧光信号很低且趋近于零时,则将导致计算异常。当我们在参比荧光设置处将 ROX 改为 None 后重新分析结果则可以得到正常,漂亮的扩增图谱了(图 7C,7D)。
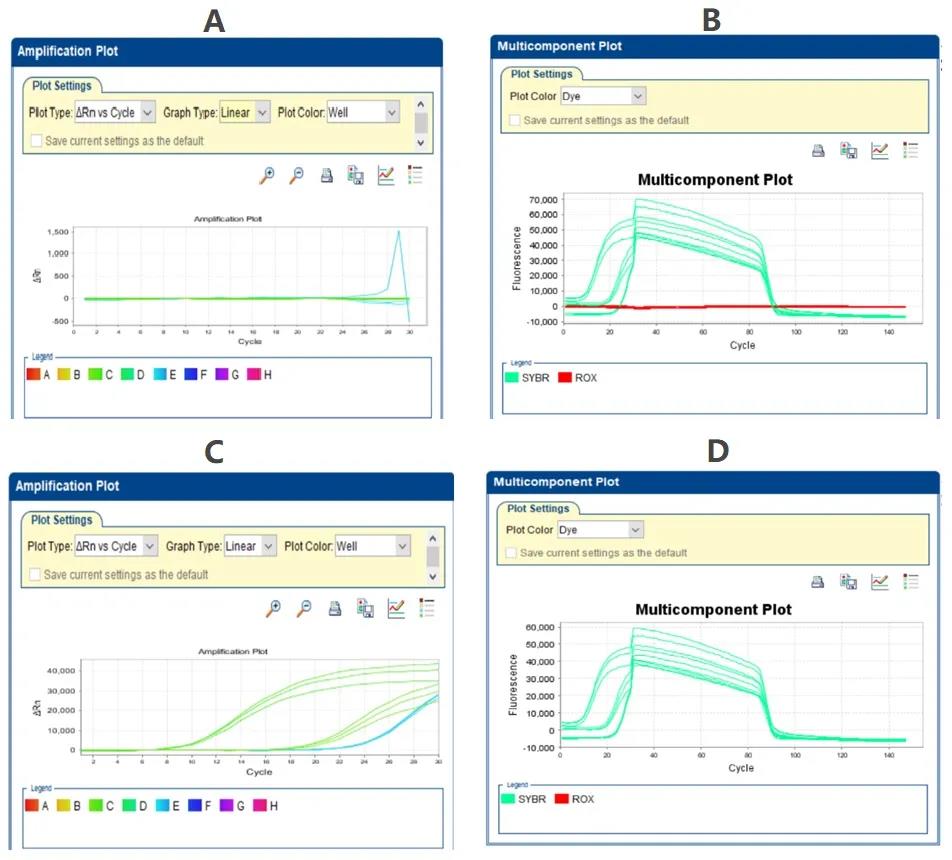 图 7 参比荧光选择错误导致扩增曲线异常
图 7 参比荧光选择错误导致扩增曲线异常
Part 4:Run Method 反应程序设置
定义好了布板信息后,接下来我们就进入了反应程序设置环节。此时我们需要结合所用试剂推荐的反应程序和引物 Tm 值等信息对反应程序进行不断摸索和逐步优化,旨在得到特异性强,灵敏度高的最佳反应程序。
在这里需要提醒大家的是一定不要忘记进行荧光信号的收集,这是我们荧光定量 PCR 反应的关键。而同样的我们需要在哪一步来收集信息呢?其实我们只需要在扩增循环中的退火或延伸步骤采集荧光即可(图 8)。
 图 8 退火/延伸步骤采集荧光信号
图 8 退火/延伸步骤采集荧光信号
不正确的信号采集同样会造成扩增曲线的异常。如下图所示,客户使用 QuantStudio™ 6 仪器开展实验,实验结束后发现扩增曲线不显示且多组分图表现异常(图 9A,9B),更进一步排查其反应程序设置可以发现,在扩增循环阶段除了在退火/延伸步骤收集荧光外,95℃ 变性步骤的荧光采集开关也被打开了(图 9C),当我们在 Analysis Settings 页面 CT Settings 下将 Data Step Selection 选择为 Stage 2, Step 2 后重新分析结果后扩增曲线和多组分图恢复正常(图 9D,9E)。
 图 9 QuantStudio™ 6 荧光采集步骤设置错误导致扩增曲线和多组分图异常
图 9 QuantStudio™ 6 荧光采集步骤设置错误导致扩增曲线和多组分图异常
经过以上一步步操作我们就完成了实验运行前的设置部分,可以发现即便是简单的程序设置也有许许多多细小的方面需要格外留意。正所谓不积跬步无以至千里,投射到一次成功的荧光定量 PCR 实验上来看,正是需要完成这环环相扣的每一步,才能得到最终漂亮,满意的结果。如果大家在实验程序设置方面仍然有不清楚的地方,也欢迎您联系我们赛默飞的技术支持,我们将全力给您提供帮助。