哺乳动物细胞中进行RNA干扰:设计,实验和分析siRNA效应
互联网
转录后基因沉默,也称为RNA干扰,是指双链RNA分子阻断或者降低同源基因的表达的现象。这种现象可能是作为一种抑制病毒感染和转座子跳跃的细胞防御机制(Ketting et. al., 1999; Tabara et. al., 1999; Jensenet. al., 1999; Ratcliff et. al., 1999)。在体内,双链RNA被内源的核糖核酸酶降解为21-23个碱基大小的小分子干扰RNA(small interfering RNAs ,siRNAs)。这种21―23碱基大小的双链RNA被认为是在哺乳动物细胞中介导RNAi反应的效应物。
RNAi技术已经被广泛应用于线虫和果蝇中基因功能的鉴定。通常将体外转录得到的长双链RNA引入这类生物中来诱导RNAi,但是这种方法在哺乳动物细胞中行不通,因为长片断的双链RNA在哺乳动物细胞中诱发强烈的抗病毒反应,导致整体基因表达模式的改变,而非特异的基因沉默反应。最新的实验表明哺乳动物细胞中导入小分子双链RNA则不会引发类似的抗病毒反应,而能够有效的找到特异的目标靶RNA而介导基因沉默。
实验范例
实验说明:
选择哺乳动物细胞中的3个基因:GAPDH, c-myc, 和一个RNA结合蛋白基因La作为研究的目标靶。相应的mRNAs序列进行分析来确定siRNA设计方案,进行siRNA制备,选择合适方法检测基因抑制的效果。根据基因的不同区域,每个基因分别设计4组不同的siRNAs。分别转染Hela细胞并检测目标靶基因表达抑制的程度。siRNA介导的基因表达抑制的程度分别通过mRNA和蛋白表达水平来检测。
超过一半以上的siRNAs对目的基因的抑制程度超过50%。siRNAs在目标靶mRNA上不同位置并没有显著影响siRNA的活性,最有效的 GAPDH siRNA被用于在不同哺乳动物细胞类型中评估siRNA的活力。转录方法制备的siRNA被证实是一种性价比高的方法,通过酶的方法制备的siRNAs至少比化学合成的siRNAs有效10倍。
siRNAs的设计 :siRNAs的设计根据 Elbashir et. al. (2001)描述的方法,带3’突出的两个U。候选的siRNAs序列分别位于mRNA靶的3’ 5’以及中部,从而验证不同的区域是否对siRNA介导的降解更为敏感。候选序列在人类基因组数据库中Blast以避免和其他基因的同源性,最后每个目标靶基因选出对应4个siRNAs。
siRNA合成 :分别用化学合成的方法和试剂盒(酶法)制备siRNAs并用常规方法定量。
转染 :哺乳动物细胞(Hela)在不含抗生素的完全培养基中生长至 40-70%汇片,分别将每个siRNAs(分别以不同的浓度),转染试剂和Opti-MEM (Invitrogen)混合,室温下孵育15―20分钟,加入siRNAs转染混合物并适当调整培养基的体积。温育48小时后后收获细胞,分别进行RNA水平分析和蛋白表达分析。
RNA纯化和分析 :常规试剂盒抽提总RNA,以分光光度剂定量。目标靶mRNA的表达水平通过Northern或者是定量RT-PCR( ABI7700)双标探针检测。
蛋白表达分析 :目标靶基因和无关对照的蛋白表达水平通过Western方法检测。或者用免疫荧光法检测。
对照 :对于全部样品,在分析目标靶mRNAs和蛋白表达水平的同时,至少有一个不相关基因的mRNA水平和蛋白表达水平同时进行分析作为对照。
实验结果:
|
|
表一:siRNAs诱导的目标mRNA和蛋白水平的下降 对不同的siRNA的效果分析可以得到一些有趣的结论:1)设计siRNA看起来比较容易成功,12个siRNAs中有7个siRNAs对基因表达的抑制效果超过50%。而参照以前的实验,8个反义RNA中只有1个有效(Stein, 2001)。2)针对mRNA上不同位点的siRNAs抑制基因表达的效果各不相同,也没有明显的位置效应。相比对照有的siRNA抑制基因表达高达到94%。3) siRNAs抑制mRNA水平和抑制蛋白表达的程度显著相关。这个结果支持“哺乳动物细胞中RNAi诱导基因沉默是通过降低mRNA的量来减少目的蛋白的表达”的推论。4)siRNAs的专一性非常高,siRNAs特异抑制基因表达,但不会对非相关基因的表达产生特别的影响。这个结论使得siRNA成为研究哺乳动物细胞中鉴定基因功能的有力工具,潜在价值不可估量。 |
Real-Time RT-PCR检测siRNA效果: 用传统方法的 real-time RT-PCR实验并不支持免疫荧光法得到的基因沉默的实验数据,比如免疫荧光法显示c-myc蛋白水平下降了65%,而用随机引物逆转录得到的cDNA进行real-time PCR的结果和对照并没有区别。
经过研究发现:在常规的逆转录操作过程中存在Endogenous random Priming (内源随机引导)的现象,虽然这种现象不影响一般的RT-PCR反应,但是对定量分析却可能会造成严重影响。采用改良的高严谨性的逆转录方法进行RT反应,对cDNA浓度进行real-time PCR,这样得到的结果显示同一个样品c-myc mRNA的水平实际下降了90-95%,这个结果和免疫荧光法的结果比较吻合。实验结果表明,在严谨的条件下进行real-time RT-PCR分析,是一种检测siRNA效果的有效工具。
体外转录制备的siRNA效果更好:
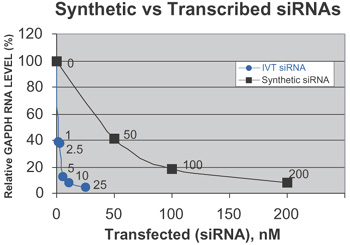
早前的实验表明化学合成的siRNA的有效转染浓度至少要比体外转录制备的siRNA高10倍以上。为了证实这个结果,在实验中分别用化学法和体外转录法合成被认为最有效的同一个GAPDH siRNA,并用同样的方法进行纯化。两种siRNAs分别以不同的浓度转染Hela细胞。和早前的结果一致,化学法合成的siRNA的最有效浓度是100―200nM,而只需要5nM的体外转录制备siRNA就可以达到同样的沉默效果。
|
|
图一:用化学合成法和体外转录法制备的 siRNAs的活性比较。用两种方法分别制备同一siRNA序列并按照不同浓度分别转染Hela细胞。收集纯化各样品的GAPDH mRNA并用Northern分析。GAPDH信号用cyclophilin探针平衡化,用磷感屏定量。 |
用siRNA在不同的哺乳动物细胞中诱导基因沉默。
siRNA在哺乳动物细胞中诱导基因沉默需要一系列的内源蛋白效应分子,为了研究不同的哺乳动物细胞对siRNA的敏感性是否有特定的规律,实验选择8种细胞株:HeLa S3, COS7, 293, NIH/3T3, A549, HT-29, CHO-KI, 和 MCF-7,选择同源序列部分最有效的siRNA,分别转染这8个细胞株。用Northern分析GAPDH和两个负对照(cyclophilin 和 28S rRNA)mRNA。结果显示,GAPDH siRNA对所有细胞株都表现出某种程度的基因沉默效果,说明基因沉默通路在多种哺乳动物细胞中是普遍存在的。
|
|
图二:不同哺乳动物细胞对siRNA诱导的基因沉默的易感性。
如图所示的细胞株分别用化学合成和体外转录制备的siRNA转染。48小时后收获细胞,分离纯化RNA,变性胶电泳,Northern分析GAPDH探针和 cyclophilin, 和28S rRNA对照。 |
讨论
siRNA是对哺乳动物细胞进行遗传分析的一种重要工具。siRNA在哺乳动物细胞中诱导的基因沉默能有效的抑制特定基因的表达。在本实验中制备并检测了3个目标基因各自分别对应的4个siRNAs,引人注目的是超过一半以上的siRNAs能非常有效的抑制目标基因的表达(抑制效果超过50%以上)。进一步的研究将着力于为什么有的siRNA效果不佳,这将有助于得到更加可靠的有效siRNA的设计标准。RNA和蛋白分析提示:只有目标蛋白收到对应的siRNA的影响。综合以上结果,只要很少一点功夫,就可以得到高效专一的抑制哺乳动物细胞某个特定基因表达的有效工具。
体外转录法制备的siRNA比化学合成法更为有效。体外转录法可以有效将一对29mer或者以上的DNA序列制备成为siRNA。由于体外转录不能有效转录小于29mer的序列,所以siRNA设计时要在5’端加上引导序列,在转录后去除,这样就可以制备任何一种siRNAs。DNA模版只需要少至25nmol的合成量,以及简单的脱盐纯化。实验表明体外转录得到的siRNA至少比化学合成的有效10倍以上。由于比较实验是基于用相同的纯化和定量方法,因此这种区别可能是由于化学合成和酶法之间的内源的区别而造成的。
一种新的分析siRNA现象的方法。实验表明siRNA诱导的目标基因沉默中mRNA和蛋白水平的下降显著正相关,这个结果支持以下推论:哺乳动物细胞中的RNAi是由于目标基因的mRNA水平下降而导致目标蛋白翻译水平下降。RNA水平分析提供一种简单方便的方法去比较同一目标基因的不同siRNAs的效果
SiRNA产品介绍:
- siRNA库 :超过10000种基因的SiRNA库,拿来就用!
-
siRNA技术 相关试剂siRNA | 反义寡核苷酸 | RNAi Oligo合成 | RNAi定量 | RNAi文库 | miRNA分离 | miRNA分析 | siRNA酶 |
siRNA标记 | siRNA纯化 | siRNA合成 | siRNA载体 | siRNA转录 | siRNA转染 | siRNA构建试剂盒 | 其它 -
siRNA表达载体
-
siRNA载体构建服务
-
siRNA
-
DNA/有机/多肽合成