FISH技术在白血病中的应用
互联网
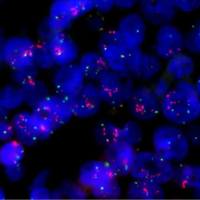
荧光原位杂交(Fluorescence In Situ Hybridization, 简称FISH)由于其直观, 快速, 敏感性高和方便灵活越来越得到广泛应用, 尤其是在血液学领域中. 因为白血病标本比较容易取得和制备, 不同类型的白血病又往往有其特异的染色体异常, FISH在白血病诊断, 治疗监测, 预后估计和微小残留病检测等诸方面都正成为不可缺少的重要手段.
FIHS技术本身也在新的需求下不断更新和完善.FISH的基本原理很简单, 就是标记了荧光的单链DNA(探针)和与其互补的DNA(玻片上的标本)退火杂交, 通过观察荧光信号在染色体上的位置来反映相应基因的情况.
FISH探针按标记方法可分为直接标记和间接标记: 用
生物
素(biotin)或地高辛(digoxingenin)标记称为间接标记, 杂交后需要通过免疫荧光抗体检测方能看到荧光信号, 因而 步骤较多, 操作麻烦, 其优点是在信号较弱或较小时可经抗原抗体反应扩大; 直接用荧光素标记DNA的方法称为直接标记. 由于直接标记的探针杂交后可马上观察到荧光信号, 省去了烦琐的免疫荧光反应, 不再需要购买荧光抗 体, 也由于近年来荧光互的亮度和抗淬灭性的不断改进和提高, 直接标记的荧光探针越来越成为首选, 如Vysis公司 的FISH探针均采用直接荧光标记, 并采用多种不同颜色的荧光, 方便在同一标本上同时检测多钟异常. 其荧光强度 和信号大小都易于在普通荧光显微镜下观察, 操作过程中也不需要严格避光, 使FISH过程变得简便而易于操作. FISH并不能取代传统的白血病MCI诊断, 但它却能使MIC分型更为准确和深入. 我们知道, MIC即细胞形态 学(M), 免疫学(I)和细胞遗传学(C), 三者结合对白血病进行分型诊断, 对不同类型的白血病采用不同治疗方案手段. 随着人们对白血病的不断认识, 仅进行MIC分型已不够全面, 还要加上对白血病的分子(M)诊断, 成为MICM分型. FISH就是连接细胞遗传学和分子
生物
学的桥梁.
白血病检测中常用的FISH探针有单一序列探针, 着丝粒探针, 整条染色体探针, 常用方法有单标记FISH, 双 标记FISH, 比较基因组杂交(CGH), M-FISH 和Rx-FISH等. 各种FISH探针及方法均在白血病的诊断, 治疗监测, 预后估计和微小残留病检测中起重要作用:
1. 白血病诊断.
白血病的细胞遗传学研究已经发现了许多白血病特异的染色体易位, 为疾病的诊断和特异治疗提供了依据. 目前, 大部分易位累及的白血病相关基因已经被克隆, 可通过检测些融合基因对白血病进行分子诊断. 常见的单一序列探 针有PML-RAR?[t(15;17), 见于M3, AML1-ETO[t(8;21), 见于M2b], BCR-ABL[t(9;22), 见于CML和ALL], TEL- AML1[t(12;21), 见于儿童前B-ALL]等等, 为方便起见, 商品化的探针多为标记的, 即两个基因分别用两种颜色标记, 同时在一张玻片标本上杂交. 用FISH进行融合基因检测比常规的染色体核型分析要准确, 其敏感性虽略低于RT- PCR方法, 但其假阳性和假阴性率却大大低于PCR法. 若核型分析, RT-PCR, FISH三者结合则可大大提高白血病诊 断的准确性.
常规细胞遗传学分析常有一些染色体易位不易发现或有不明来源的标志染色体或有复杂的染色体易位不易诊 断. FISH则可解决这些难题. 白血病的染色体异常分为染色体数目异常和结构异常. 对数目异常, 可采用染色体着 丝粒探针或整条染色体探针[又称为染色体涂色(Chromosome painting, CP)探针]. 如慢性粒细胞性白血病急变时常常 出现8号染色体三体. 此时8号着丝粒探针或CP探针就很容易诊断了. 目前, 几乎所有染色体均已有了商品化的着 丝粒和CP探针. CP探针也适用于标志染色体和不易发现或复杂的染色体易位的检测, t(12;21)的发现就是最好的例子. 染色体涂色往往要在核型分析的基础上, 选择可能发生异常染色体探针做杂交, 如果三条以上染色体发生复杂的交互 易位, 需要多次杂交分析才能确定.
为解决这一问题, 在染色体涂色的基础上开发了M-FISH技术. M-FISH相当于在 一次杂交中给每一条染色体都涂上了不同的颜色, 因而很容易就可看到多条染色体间的复杂易位情况和确定标志染 色体的来源. M-FISH因其这一优点正成为分子遗传学家手中重要工具, 然而, 对同一条染色体中的易位或倒位它就 无能为力了, 而且, 它也不能精确地显示染色体断裂的区带. 能否让每条区带也杂交上不同的颜色呢? 这一想法导 致了彩色核型分析(Rx-FISH)的诞生. 它几乎解决了上述所有的问题, 然而Rx-FISH探针价格不菲, 目前已有多家公 司正在开发和改进中. 不论是哪一种FISH, 其成功与否都与染色体标本的质量密切相关, M-FISH和Rx-FISH的要求 尤其较高.
除了M-FISH和Rx-FISH外, 在血液病研究中使用较多的一种FISH相关技术是比较基因组杂交(Comparative Genomic Hybridization, CGH). CGH与上述的各种方法有所不同, 它不需要制备患者的染色体标本, 只需抽提肿瘤 组织和正常组织的基因组DNA, 分别标记后作为探针与正常人染色体杂交即可, 因而CGH最适合于检测实体瘤, 淋巴瘤等不易得到高质量染色体标本的疾病. CGH另一无法替代的优点是, 它可在一次杂交中检测整个基因遗传 物质的增加或减少, 但精度有限, 对微小的扩增或缺失检测不出, 仅适用于对整个基因组进行筛查. CGH也无法发 现平衡染色体易位.
从以上介绍可以看出: 各种FISH技术为白血病诊断提供了多样的手段, 各种方法有其特定的适用范围, 应根据 需要结合使用.
2. 预后估计, 治疗监测和微小残留病检测;
白血病的预后估计, 治疗监测和微小残留病检测都基于某种类型白血病特异的染色体或基因改变, 如对M3病 人首先检测是否伴有t(15;17)/ PML-RARA或t(11;17)/PLZF/RARA, 如果有PML-RARA 融合基因则用全反式维甲酸 治疗预后好, 而伴有PLZF/RARA则预后较差且需选择其它治疗方案. 初发时检测出的异常可作为治疗监测和随访 过程中检测微小残留病变的有效指标, 进行跟踪监测. 在疾病初发和每次开始治疗前检测有否分子遗传学异常非常 重要.
目前, 检测手段主要依靠RT-PCR, 因为其敏感性高和易于开展, 但也常出现假阳性和假阴性问题, 影响了其准 确性, 并且无法量化. 近年来, 实时PCR很好地解决了量化的问题, 其缺点是成本较高, 探针种类有限, 目前仅能检测 PML-RARA和AML1-ETO融合基因. 另一在国际上更为广泛应用的方法是间期FISH. 间期FISH由于不需制备染色体 标本, 节省了大量时间, 又由于商品化探针质量可靠, 操作步骤简单而达到快速, 简便的要求. 间期FISH还具有可量 化和假阳性, 假阴性率低的优点, 且其敏感性仅比PCR方法略低, 完全符合临床诊断的需要, 应用不同颜色的荧光探 针还可同时检测多个基因异常.
综上所述, FISH在血液病中的应用相当广泛, 但在我国的血液病临床上应用还不多. 由于FISH具有直观, 敏感, 方便, 可量化和方法多样, 适应不同检测的目的等优点, 随着FISH技术的发展, 成本的降低和探针种类和质量的进 一步提高, FISH必将成为血液病临床及基础研究的重要手段.