基于不同光学平台的荧光共振能量转移(FRET) 技术
互联网
[摘 要]: 荧光共振能量转移( FRET)是用于对生物大分子之间相互作用定性、定量检测的一种有效方法。根据所基于的荧光显微镜配置不同而有不同的应用侧重,可在溶液,细胞悬液,多细胞,单细胞,细胞膜,细胞器等不同层次对生物大分子间的相互作用距离,动力学特性等进行研究。本文就基于常规宽场荧光显微镜、全内反射荧光显微镜,连续激光共聚焦显微镜、脉冲多光子激发显微镜等显微技术的FRET方法分别进行了介绍和对比评估。对于实验室应用和配置FRET系统具有参考意义.
[关键词]: 荧光共振能量转移,W-FRET,TIRF-FRET, Confocal- FRET,MP-FRET
1介绍
随着生命科学研究的不断深入, 光学显微镜使我们理解了细胞结构和有关功能。但是分子生物学研究已经显示了分子事件,例如信号传导和基因翻译,需要蛋白质的装配成特殊的大分子复合体等。对各种生命现象发生的机制,特别是对细胞内蛋白质间相互作用的研究变得尤为重要。传统的生物物理或生物化学方法例如亲和色谱法或免疫沉淀反应法和近来的酵母双杂交、磷酸化抗体、免疫荧光、放射性标记等方法等,都需要破碎细胞或对细胞造成损伤,无法做到在活细胞生理条件下实时地对细胞内蛋白质-蛋白质间相互作用进行动态研究。
而基于强度的影像技术例如FRET方法(宽场,共聚焦,双光子),使得研究活细胞内的这些相互作用变得容易了(Periasamy, 2001)。新的影像技术,结合开发新的基因编码的荧光基团标记和传感器以及计算机影像采集和分析软件的能力增强,使许多复杂的研究例如蛋白质功能和加工、基因表达和第二信使传递、胞内信号传导等研究成为可能。(Roessel and Brand, 2002).
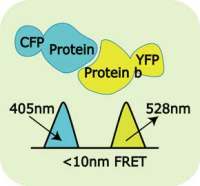
FRET是通过分子间的电偶极相互作用将供体激发态能量转移到受体激发态的过程,它是一种非辐射跃迁[2 ],发生FRET时,分子间距离小于10nm。如果发生FRET,则供体通路信号将淬灭而受体通路信号将激活或增强(Herman, 1998)。FRET显微技术高度依赖如何快速高效地捕获来自标定分子间相互作用的短暂微弱的荧光信号的能力。由于能量传递发生在1-10nm,一个FRET信号代表了一个显微镜图象中的一个特殊位置。这等效于提供了一个额外的放大倍数,使 FRET超越显微镜的分辨率限制而以分子尺度分辨出供体-受体的平均距离,并能显示出受体-供体的相互作用。
2基于不同光学平台的FRET显微技术
FRET供体受体配对
广泛用于FRET研究的的供体-受体荧光基团来自自发荧光蛋白GFPs.。选择GFPs作为可工作的FRET对,要仔细考虑其光谱特性:对选定的供体受体配对,它们的激发光谱要足够分离,供体发射光谱与受体激发光谱部分重叠(>30%)以获得足够的能量传递;供体受体发射光谱的合理分隔,以便独立测量每个荧光基团的荧光。
根据生物学应用的不同,有一些FRET对的组合。常用的FRET对荧光基团有:CFP-YFP;CFP-dsRED;BFP-GFP;GFP-dsRED;YFP-dsRED;Cy3-Cy5;Alexa488-Alexa555;Alexa488-Cy3;FITC- Rhodamine (TRITC);YFP-TRITC ;YFP- Cy3。
FRET方法配置
FRET方法可以基于不同的光学平台配置,适用面很宽。一般的FRET系统都包含如下配置:
激发光源:稳定的汞灯、氙灯、汞氙复合电弧灯光源;从紫外到红外波段不同波长的激光光源。
中性密度滤光片:用以控制激发光的强度。
滤镜组:为选定的荧光基团组合配置合适的滤镜组,包括激发,发射,二色分光等。需要仔细选择滤镜组合,以削减光谱串色,提高FRET信号的信号噪声比。
检测设备:高灵敏度PMT或冷CCD。
根据所使用的光学平台配置,可将FRET显微技术分为如下两类:单光子激发和多光子激发。单光子激发类中包括基于常规宽场的(Wide-Field)W-FRET,全内反射TIRF-FRET),共聚焦(confocal)C-FRET。多光子激发中包括双光子和多光子(MP-FRET)。