荧光共振能量转移技术的基本原理和应用
互联网
荧光共振能量转移(fluorescence resonance energy transfer,FRET)作为一种高效的光学“分子尺”,在生物大分子相互作用、免疫分析、核酸检测等方面有广泛的应用。在分子生物学领域,该技术可用于研究活细胞生理条件下研究蛋白质-蛋白质间相互作用。
蛋白质-蛋白质间相互作用在整个细胞生命过程中占有重要地位,由于细胞内各种组分极其复杂,因此一些传统研究蛋白质-蛋白质间相互作用的方法如酵母双杂交、免疫沉淀等可能会丢失某些重要的信息,无法正确地反映在当时活细胞生理条件下蛋白质-蛋白质间相互作用的动态变化过程。FRET技术是近来发展的一项新技术,为在活细胞生理条件下对蛋白质-蛋白质间相互作用进行实时的动态研究提供了便利。
一、FRET技术基本原理
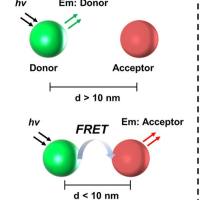
荧光共振能量转移是指两个荧光发色基团在足够靠近时,当供体分子吸收一定频率的光子后被激发到更高的电子能态,在该电子回到基态前,通过偶极子相互作用,实现了能量向邻近的受体分子转移(即发生能量共振转移)。
FRET是一种非辐射能量跃迁,通过分子间的电偶极相互作用,将供体激发态能量转移到受体激发态的过程,使供体荧光强度降低,而受体可以发射更强于本身的特征荧光(敏化荧光),也可以不发荧光(荧光猝灭),同时也伴随着荧光寿命的相应缩短或延长。能量转移的效率和供体的发射光谱与受体的吸收光谱的重叠程度、供体与受体的跃迁偶极的相对取向、供体与受体之间的距离等因素有关。作为共振能量转移供、受体对,荧光物质必须满足以下条件:
①受、供体的激发光要足够分得开;
②供体的发光光谱与受体的激发光谱要重叠。
人们已经利用生物体自身的荧光或者将有机荧光染料标记到所研究的对象上,成功地应用于核酸检测、蛋白质结构、功能分析、免疫分析及细胞器结构功能检测等诸多方面。(传统有机荧光染料吸收光谱窄,发射光谱常常伴有拖尾,这样会影响供体发射光谱与受体吸收光谱的重叠程度,而且供、受体发射光谱产生相互干扰。最新的一些报道将发光量子点用于共振能量转移研究,克服了有机荧光染料的不足之处。
相对于传统有机荧光染料分子,量子点的发射光谱很窄而且不拖尾,减少了供体与受体发射光谱的重叠,避免了相互间的干扰;由于量子点具有较宽的光谱激发范围,当它作为能量供体时,可以更自由地选择激发波长,可以最大限度地避免对能量受体的直接激发;通过改变量子点的组成或尺寸,可以使其发射可见光区任一波长的光,也就是说它可以为吸收光谱在可见区的任一生色团作能量供体,并且保证了供体发射波长与受体吸收波长的良好重叠,增加了共振能量转移效率。)
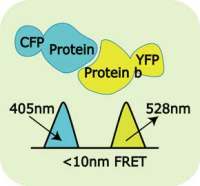
以GFP的两个突变体CFP(cyan fluorescent protein)、YFP(yellow fluorescent protein)为例简要说明其原理:CFP的发射光谱与YFP的吸收光谱有相当的重叠,当它们足够接近时,用CFP的吸收波长激发,CFP的发色基团将会把能量高效率地共振转移至YFP的发色基团上,所以CFP的发射荧光将减弱或消失,主要发射将是YFP的荧光。两个发色基团之间的能量转换效率与它们之间的空间距离的6次方成反比,对空间位置的改变非常灵敏。例如要研究两种蛋白质a和b间的相互作用,可以根据FRET原理构建融合蛋白,这种融合蛋白由三部分组成:CFP(cyan fluorescent protein)、蛋白质b、YFP(yellow fluorescent protein)。
用CFP吸收波长433nm作为激发波长,实验灵巧设计,使当蛋白质a与b没有发生相互作用时,CFP与YFP相距很远不能发生荧光共振能量转移,因而检测到的是CFP的发射波长为476nm的荧光;但当蛋白质a与b发生相互作用时,由于蛋白质b受蛋白质a作用而发生构象变化,使CFP与YFP充分靠近发生荧光共振能量转移,此时检测到的就是YFP的发射波长为527nm的荧光。将编码这种融合蛋白的基因通过转基因技术使其在细胞内表达,这样就可以在活细胞生理条件下研究蛋白质-蛋白质间的相互作用。
二、FRET技术的应用
随着生命科学研究的不断深入,对各种生命现象发生的机制,特别是对细胞内蛋白质-蛋白质间相互作用的研究变得尤为重要。而要想在这些方面的研究取得重大突破,技术进步又是必不可少的。
一些传统的研究方法不断发展,为蛋白质-蛋白质间相互作用的研究提供了极为有利的条件,但同时这些研究手段也存在不少缺陷:如酵母双杂交、磷酸化抗体、免疫荧光、放射性标记等方法应用的前提都是要破碎细胞或对细胞造成损伤,无法做到在活细胞生理条件下实时的对细胞内蛋白质-蛋白质间相互作用进行动态研究。FRET技术的应用结合基因工程等技术正好弥补了这一缺陷,下面是FRET技术在相关生命科学领域中的具体应用。
1、检测酶活性变化
(1)活细胞内检测蛋白激酶活性
蛋白质磷酸化是细胞信号转导过程中的重要标志,研究其中的酶活性是研究信号通路的一个重要方面。以前酶活性测定主要是利用放射性以及免疫化学发光等方法,但前提都是要破碎细胞,用细胞提取物测定酶活性,还无法做到活细胞内定时、定量、定位的观测酶活性变化。
而利用FRET方法就可以很好的解决这个问题:如Zhang等人利用FRET原理设计了一种新的探针(一种融合蛋白):新探针包含一个对已知蛋白激酶特异性的底物结构域,一个与磷酸化底物结构域相结合的磷酸化识别结构域。这个探针蛋白的两端是GFP的衍生物CFP与YFP,利用FRET原理工作。
当底物结构域被磷酸化后,分子内部就会发生磷酸化识别结构域与其结合而引起的内部折叠,两个荧光蛋白相互靠近就会发生能量迁移。如果磷酸酶进行作用将其去磷酸化,分子就会发生可逆性的变化。该研究小组用几组嵌合体来研究四种已知蛋白激酶的活性:PKA(protein kinase A)、Src、Abl 、 EGFR(epidermal growth factor receptor)。
他们将构建的报导探针转入细胞,根据FRET来检测激酶活性变化。对细胞进行生长因子处理后,几种酪氨酸激酶都在几分钟内被激活,检测到25%-35%的活性变化。用forskolin激活PKA能增强FRET 25%-50%的变化,激酶在整个细胞质范围内被激活。如果将报导探针加上核定位信号使之定位于核中,则FRET变化被极大的延迟了,这也说明了PKA作用的区域性。由此可见,利用FRET方法可以很好的观察活细胞内酶活性变化,并且能做到定时、定量、定位,是一种非常有效的研究手段。
(2)关于细胞凋亡的研究
细胞凋亡过程大致可以分为三个不同的阶段:起始期-细胞通过不同途径接受多种与凋亡有关的信号;整合期-多种信号在此整合,细胞做出生存或死亡的决定;执行期-一旦做出死亡的决定,即将进入一个不可逆转的程序。天冬氨酸特异的半胱氨酸蛋白酶(cysteinyl aspartate-specific protease,Caspase)在细胞凋亡的执行期发挥关键作用,近年来对其研究成为细胞凋亡领域的一个热点。而FRET技术的出现对此的研究提供了更为有利的条件:Reiko Onuki等人利用FRET技术研究了Caspase8与Bid蛋白之间的相互作用,Caspase8活化后作用Bid蛋白,使其裂解成两个片段,然后羧基片段转移到线粒体使其释放细胞色素C诱发细胞凋亡细胞凋亡。
研究者将Bid蛋白两端分别与CFP与YFP融合,精心设计使其在没有被裂解前刚好可以发生FRET,当Bid蛋白被裂解后FRET效应自然消失。所以是一种很好的检测Caspase8酶活性方法,而且当Bid蛋白与CFP与YFP融合之后仍能行使正常的功能,当融合物在细胞内被裂解后,连接CFP的片段转移到线粒体,通过CFP荧光可以很清楚的观测到其在细胞内的定位。另外Markus Rehm与Kiwamu Takemoto等人利用FRET技术设计了可以反映Caspase3酶活性变化的融合报告蛋白,通过此报告蛋白证实了在细胞凋亡过程中Caspase3酶活性变化是一个非常迅速的过程。
2、关于膜蛋白的研究
(1)受体激活效应在细胞膜上的横向扩散
膜蛋白的研究一直都是信号通路研究中的重点和难点。当细胞膜局部受外界刺激后,相应受体被激活然后向细胞内传导信号,可是在这之前是否会有细胞膜上的横向效应呢?近来Peter等人在Science上报道:细胞膜局部受刺激后,膜受体活化效应可迅速扩展到整个细胞膜。他们将膜受体EGFR(epidermal growth factor receptor)与GFP融合,抗活化后的EGFR抗体用Cy3染料标记,刺激因子EGF(epidermal growth factor)用Cy5染料标记,这样可以很明显的看到EGF在细胞膜上的局部分布。当EGF作用细胞后,EGFR活化并与其抗体结合,于是GFP与Cy3染料充分接近发生FRET,利用此方法可以很明显的观测到细胞膜局部受刺激后,受体活化效应迅速扩散到整个细胞膜。
(2)膜蛋白的定位修饰
我们知道膜蛋白是定位在细胞膜上不同的亚区域中,例如脂质筏(lipid rafts)和小窝(caveolae),小窝包含着丰富胆固醇、鞘磷脂和信号蛋白。那么这些蛋白怎样到达它们的目的地呢?Zacharias等在Science上报道,酰基化足以使这些蛋白定位在脂质筏。他们的研究是通过FRET(fluorescence resonance energy transfer)技术,用GFP的突变体CFP(cyan fluorescent protein)和YFP(yellow fluorescent protein)来进行。因为这些蛋白并没有细胞内定位序列,所以研究者将各种酰基化修饰的敏感序列加在这些蛋白上,研究它们在细胞膜上的分布。因为分布的微结构域非常小,所以当CFP和YFP共分布在同一个微结构域时,就可以用FRET来观测到。研究者最初是用激酶Lyn的酰基化序列加在这些荧光蛋白上,使myristoyl和palmitoyl侧链链接在CFP和YFP的氨基端。结果发现产生的FRET信号非常强,用能去除胆固醇而使小窝和脂质筏消失的MCD(5-methyl-β-cyclodextrin)处理也不能使荧光消失,所以这说明荧光蛋白已经非常牢固的结合在了一起。然后研究者用荷电的基团代替荧光蛋白上疏水的基团时,发现聚体形成被抑制了。
3、细胞膜受体之间相互作用
外界刺激因素向细胞内的信号传递一般认为通过其在胞膜上的受体,当配体与受体结合后,引起受体构象变化或化学修饰,介导信号传递。但是最近关于Fas及其同源物TNFR(均为胞膜上的三聚体受体)的研究发现:它们都可以在无配体存在的情况下自发组装,并介导信号传递,引发细胞凋亡细胞凋亡。其中在鉴定Fas发生三聚体化的实验中使用了FRET技术:将Fas分别与CFP与YFP融合,利用此项技术可以很方便的观测到Fas单体是否发生聚合。Yogesh Patel等人研究两种递质多巴胺与抑生长素。发现SSTR5(the type 5 somatostatin receptor)与D2R(type 2 dopamine receptor)共同分布在大鼠脑中的一些神经元中,他们将两者共表达,发现加入多巴胺能的激活剂能增强SSTR5与somatostatin的亲和性,加入多巴胺拮抗剂能抑制SSTR5的信号传递,表达D2R能恢复SSTR5突变体与腺苷环化酶的偶联。这不由是人们想到:两种受体之间是否存在某种联系呢?终于,应用FRET技术(SSTR5用红色染料标记,D2R用绿色染料标记)发现了两者之间的直接相互作用。而且当两受体的配体都存在时才出现FRET,说明两受体被激活时才发生相互作用。
4、细胞内分子之间相互作用
Rho家族的小G蛋白通过调节肌动蛋白的多聚化调控着重要的生理功能,象其他信号分子一样,这些GTPase的效应在时间和空间上都非常集中,那么如何检测它们活性的时空动力学呢? Klaus Hahn等在Science上报道了一种新的技术FLAIR(fluorescence activation indicator for Rho proteins)可很好的解决这个问题:他们将PAK1的能结合并激活Rac-GTP的domain PDB与荧光染料Alexa标记,微注射入表达GFP与Rac融合蛋白的细胞中。这样,当Rac与PDB相互作用时,GFP和Alexa就会足够接近以致发生FRET.这种方法能够实时的检测到在一个活的细胞中Rac的定位改变与Rac激活之间的关系。
Matsuda 等人在Nature上报道关于细胞内Ras和Rap1激活,也是用了FRET技术:他们将Ras和Raf的Ras结合结构域(Raf RBD)与GFP的突变种YFP和CFP进行融合构建。他们将Ras和YFP融合,RafRBD与CFP融合,当两分子靠的足够近时,它们之间就会激发FRET,设计的蛋白Raichu-Ras,Raichu代表和Ras结合的嵌合单元。当把Raichu-Ras与特异性的GEFs(guanine-nucleotide exchange factors)和GAPs(GTPase-activating proteins)共表达,清楚的显示FRET的增加和减少与Ras突变体的激活和抑制有关。此外他们还用同样原理观测了Rap1激活。