蛋白质组学研究双相凝胶电泳分离技术
互联网
1670
蛋白质组学研究双相凝胶电泳分离技术
蛋白质 组学研究主要依赖于大规模高通量分离和分析技术的进步,目前最成熟、最有效的技术仍然是双相凝胶电泳分离―生物质谱鉴定技术,即首先用双相凝胶电泳分离纯化蛋白质,结合计算机软件分析得到电泳图谱,再进一步用生物质谱技术对分离出的蛋白质进行鉴定,并运用现代生物信息学的技术对所得到的数据进行处理,对蛋白质及其执行的生命活动做出尽可能精细、准确及本质的阐述。下面简要介绍目前蛋白质组学主要技术的发展。
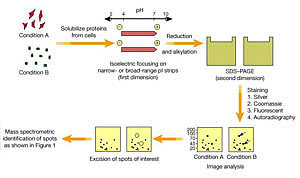
双相凝胶电泳技术是蛋白质组研究中最早的支撑技术之一。双相凝胶电泳的双相指第一相为等电聚焦电泳(IEF,等电点信息),第二相为SDS凝胶电泳(SDS―PAGE,相对分子质量信息)。早期双相电泳中第一相用载体两性电解质产生pH梯度。固相pH梯度(1PG)等电聚焦技术大大改善了双相电泳的分辨率、重复性和上样量。根据所采用的胶条的大小和pH梯度的不同,二维凝胶电泳可以同时分离5 000个蛋白质点,能检测<1ng的蛋白质点,同时它能提供一个完整的蛋白质表达图谱,从而可以反应蛋白质表达量的变化,以及异构体(isoform)或翻译后修饰的情况。而液相色谱质谱联用方法(LC―MS/MS)鉴定的是肽段,因此等电点和相对分子质量的信息丢失了,而且需要用同位素标记进行定量比较。
由于双相凝胶电泳对批量蛋白质可实现一次分离,具有高分辨率,便于计算机进行图像分析处理,可以很好地与质谱分析等鉴定方法匹配,以及能够研究蛋白的翻译后修饰(如磷酸化,糖基化等)等优点,因而成为目前分离蛋白质组分的核心技术。但是双相凝胶电泳技术仍然存在许多不足,对于疏水性蛋白质、极酸或极碱蛋白质、高相对分子质量蛋白质以及极微量蛋白质的分辨率仍感困难。目前对双相凝胶电泳技术的改进主要集中在疏水性蛋白质样品的制备、分离能力的改善,以及染色方法等方面。
双相电泳成功的关键在于建立一套有效的、可重复的样品制备方法。由于样品种类的差异和实验需求的不同,没有一种样品提取方法能适用于各种样品,绝大多数样品都需要通过多次实验才能摸索到最适宜的双相电泳条件。目前对疏水性蛋白质样品的制备,常选用含有多种离液剂、去垢剂和还原剂的复杂混合溶液,Bio―Rad和Amersham Pharmacia公司都有相应产品,可以获得相对理想的提取。
窄IPG技术的发展提高了电泳的分辨率,把IPG胶条的pH梯度范围缩小至1~1.5pH,通过多个连续pH范围的窄IPG代替单个宽范围的lPG。同时用增加分离距离的方法提高双相电泳的分辨力,24cm的窄lPG胶条可以得到非常高的分辨力。
双相电泳的考马斯亮蓝染色灵敏度较低,银染虽然灵敏度高但重复性较差。荧光染色是较新的染色方法,灵敏度与银染相似,但速度快且结果可靠。用两种不同颜色的荧光染料分别标记两个样品,然后混合电泳及结果分析,可以明显提高双相电泳的重复性。