《PNAS》:在活细胞中观察泛素修饰蛋白
丁香园论坛
1958
泛素(Ubiquitin)功能多样,它参与了包括细胞分裂,DNA修复以及细胞程序性死亡等多个生命过程。泛素化作用是一种小分子肽即泛素连接到一个蛋白质并改变蛋白功能和在细胞中的位置的过程。起初研究人员认为泛素只是一种针对不需要或有害蛋白的一个“摧毁”信号,但是后来发现这个小分子与许多其它分子功能有关。
现在,密歇根大学和Howard Hughes医学研究所的研究人员找到了一种观察泛素标记的活细胞中蛋白质的方法。这些结果公布在本周的Proceedings of the National Academy of Sciences的网络版上。
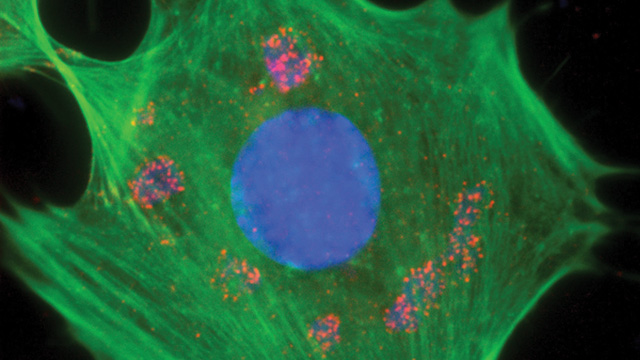
新的研究中,研究人员首次利用一种叫做泛素媒介荧光互补法(ubiquitin-mediated fluorescence complementation)来研究细胞中的泛素化作用。研究人员在文章中叙述了泛素连接到Jun蛋白(位于细胞核内)并将此蛋白转移到溶酶体(位于核外的细胞质中)中的过程。Jun蛋白的功能是瞬时的,如果它被打开并且无法关闭,就会导致细胞的异常生长和其它问题。而泛素化作用则通过转移作用来消除它的转录功能。他们还发现与Itch酶结合的E3连接酶能够用泛素标记Jun,这一步也是这种蛋白移向溶酶体所必须的。如果Itch不能识别Jun,Jun就会在细胞中积累起来,并因此会扰乱基因转录和细胞生长的调节过程。
将这种新技术用在Jun蛋白上,能够找到有关细胞中Jun转移调控的新信息。这项技术利用了一种荧光蛋白的互补片断。当泛素与目的蛋白发生连接时,这些片断就会互补并产生亮点,从而使研究人员能够在荧光显微镜下观察到。因此,研究人员利用这种方法能够确定泛素化蛋白在细胞中的位置。 <BR><BR>这项技术能够让研究人员在显微镜下观察生活细胞中的被泛素修饰的蛋白,而这种可视化的方法也是研究人员直接观察到之前只能在试管中间接研究的细胞过程。因此,这种方法将会加速与泛素有关的分子过程的研究。
全文链接 http://www.pnas.org/cgi/reprint/0404445101v1.pdf
fx78申请加入“中级FTP区”,希望大家支持,谢谢
http://www.dxy.cn/bbs/post/view?bid=17&id=1801755&sty=1&tpg=1&age=0
现在,密歇根大学和Howard Hughes医学研究所的研究人员找到了一种观察泛素标记的活细胞中蛋白质的方法。这些结果公布在本周的Proceedings of the National Academy of Sciences的网络版上。
新的研究中,研究人员首次利用一种叫做泛素媒介荧光互补法(ubiquitin-mediated fluorescence complementation)来研究细胞中的泛素化作用。研究人员在文章中叙述了泛素连接到Jun蛋白(位于细胞核内)并将此蛋白转移到溶酶体(位于核外的细胞质中)中的过程。Jun蛋白的功能是瞬时的,如果它被打开并且无法关闭,就会导致细胞的异常生长和其它问题。而泛素化作用则通过转移作用来消除它的转录功能。他们还发现与Itch酶结合的E3连接酶能够用泛素标记Jun,这一步也是这种蛋白移向溶酶体所必须的。如果Itch不能识别Jun,Jun就会在细胞中积累起来,并因此会扰乱基因转录和细胞生长的调节过程。
将这种新技术用在Jun蛋白上,能够找到有关细胞中Jun转移调控的新信息。这项技术利用了一种荧光蛋白的互补片断。当泛素与目的蛋白发生连接时,这些片断就会互补并产生亮点,从而使研究人员能够在荧光显微镜下观察到。因此,研究人员利用这种方法能够确定泛素化蛋白在细胞中的位置。 <BR><BR>这项技术能够让研究人员在显微镜下观察生活细胞中的被泛素修饰的蛋白,而这种可视化的方法也是研究人员直接观察到之前只能在试管中间接研究的细胞过程。因此,这种方法将会加速与泛素有关的分子过程的研究。
全文链接 http://www.pnas.org/cgi/reprint/0404445101v1.pdf
fx78申请加入“中级FTP区”,希望大家支持,谢谢
http://www.dxy.cn/bbs/post/view?bid=17&id=1801755&sty=1&tpg=1&age=0