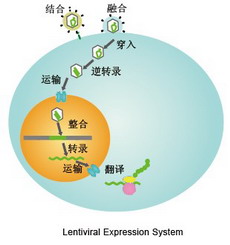
【共享】慢病毒包装操作步骤
丁香园论坛
5344
★ 慢病毒包装操作步骤:
1. 在转染的前一天,传代准备细胞:用0.25%胰蛋白酶消化293T细胞,以含10%血清的DMEM培养基调整细胞密度后,按照每10cm细胞培养皿接种6~8×106cells到10cm细胞培养皿中,置于37℃,5% CO2 培养箱培养,16h~24h后待细胞密度生长到80%~90%时即可用于转染。 2. 第二天,在转染前2~4h,用5ml不含P/S的完全培养基换液(DMEM+10% FBS)。 3.按照以下实验步骤来进行转染: A、加入500ul HET Buffer A到一支洁净的1.5ml EP管中(可标记为A管) B、在另一支洁净的1.5ml EP管中(可标记为B管),加入以下试剂,终体系为500ul
试剂名称
试剂数量
Vector
10ul(1.0ug/ul)
Lentiviral packaging mixture
15ul(1.0ug/ul)
HET Buffer B
50ul
ddH2O
425ul
C、将B管中的DNA温合液缓缓逐滴加入到A管中,用移液器轻轻混匀10min。
D、将混匀后的混合物室温静置30min,然后将混合物逐滴均匀加入到10cm细胞培养皿中,轻微混匀。置于37℃,5% CO2培养箱中培养。 4. 第三天,即培养12h~16h后弃去培养基,用10ml新鲜的完全培养基换液(DMEM+10% FBS+P/S)。 5. 第四天,即换液后24h,收集上清液,置于4℃冰箱保存,然后加入10ml新鲜的完全培养基(DMEM+10% FBS+P/S)至10cm细胞培养皿中,置于37℃,5% CO2培养箱继续培养。 6. 第五天:再一次收集上清,与第一次收集的上清液混合,1000rpm离心5min,弃去细胞碎片,上清液以 0.45 μm PVDF滤器过滤至50ml圆底离心管中。 7. 4℃,50000g 高速离心2h,离心后可用记号笔对病毒沉淀做好标记 。 8. 小心弃去上清,晾干,按200ul /10cm培养皿的量加入DMEM(不含血清、双抗)或者PBS重悬病毒沉淀,室温静置2h,然后用移液器轻轻地吹匀(避免产生气泡),继续室温放置30min,按每次使用的病毒量分装到洁净的1.5ml EP管中,-80 ℃ 冰箱保存。
★ 慢病毒生物学滴度测定操作步骤:
1. 在滴度测定的前一天取一块48孔板,按照每孔3×104cells的密度接种HEK 293细胞。 2. 加polybrene到新鲜的完全培养基中(DMEM+10% FBS+P/S),使其终浓度为8ug/ml。 3. 用含有polybrene的完全培养基10倍梯度稀释病毒,具体做法如下:取一个96孔板,每孔含有90ul培养基,第一个孔加入10ul待测病毒原液,混匀后吸取10ul病毒混合液至第二个孔(混匀时尽量不要产生气泡),如此稀释至第六个孔(即稀释105倍)。
Titer
1ul
0.1 ul
0.01 ul
0.001 ul
0.0001 ul
Virus Stock
5 or 10
10
10
10
10
Medium with 8ug/ml polybrene
45 or 90
90
90
90
90
Load volume
10
10
10
10
10
4. 各吸取10ul病毒稀释液到相对应的48孔板中,置于37℃,5% CO2 培养箱培养过夜,16h~24h后用新鲜的完全培养基换液(DMEM+10% FBS+P/S)。 5. 置于37℃,5% CO2 培养箱培养48h后,用荧光显微镜计数荧光细胞数量(如果观察不清晰可以先用PBS(pH7.4)换液后再进行观察)。一般情况下,在最高稀梯度10m的孔数出现N(N<10)个带荧光的细胞,则病毒滴度为Nx10mTU/ul(10m为稀释倍数),即病毒滴度为Nx10m+3TU/ml,若N>10,则需要继续稀释。
★ 使用注意事项:
1. 需要使用去内毒素的质粒抽提试剂盒来抽提质粒,而且质粒OD260/OD280的比值在1.8~2.0之间。
2. 细胞生长状态对于病毒包装至关重要,因此需要保证良好的细胞生长状态和较少的细胞传代次数,细胞代数不要超过20代。
3. 在质粒转染时细胞培养基里面不要添加抗生素(如P/S、G418等)。
4. 病毒包装试剂盒应与HET高效转染试剂盒配套使用才能达到最佳的病毒包装效率;一般来说包装基因过表达的慢病毒其生物学滴度能够达到107~108TU/ml,而包装RNAi的慢病毒其生物学滴度能够达到108~109TU/ml。
5. 病毒切勿反复冻融,冻融次数尽量不要超过3次,每冻融一次大约有10%左右的病毒损失,应按每次使用的病毒量来分装然后冻存于-80度冻箱,保存时间尽量不要超过6个月。扣群交流198062731
1. 在转染的前一天,传代准备细胞:用0.25%胰蛋白酶消化293T细胞,以含10%血清的DMEM培养基调整细胞密度后,按照每10cm细胞培养皿接种6~8×106cells到10cm细胞培养皿中,置于37℃,5% CO2 培养箱培养,16h~24h后待细胞密度生长到80%~90%时即可用于转染。 2. 第二天,在转染前2~4h,用5ml不含P/S的完全培养基换液(DMEM+10% FBS)。 3.按照以下实验步骤来进行转染: A、加入500ul HET Buffer A到一支洁净的1.5ml EP管中(可标记为A管) B、在另一支洁净的1.5ml EP管中(可标记为B管),加入以下试剂,终体系为500ul
试剂名称
试剂数量
Vector
10ul(1.0ug/ul)
Lentiviral packaging mixture
15ul(1.0ug/ul)
HET Buffer B
50ul
ddH2O
425ul
C、将B管中的DNA温合液缓缓逐滴加入到A管中,用移液器轻轻混匀10min。
D、将混匀后的混合物室温静置30min,然后将混合物逐滴均匀加入到10cm细胞培养皿中,轻微混匀。置于37℃,5% CO2培养箱中培养。 4. 第三天,即培养12h~16h后弃去培养基,用10ml新鲜的完全培养基换液(DMEM+10% FBS+P/S)。 5. 第四天,即换液后24h,收集上清液,置于4℃冰箱保存,然后加入10ml新鲜的完全培养基(DMEM+10% FBS+P/S)至10cm细胞培养皿中,置于37℃,5% CO2培养箱继续培养。 6. 第五天:再一次收集上清,与第一次收集的上清液混合,1000rpm离心5min,弃去细胞碎片,上清液以 0.45 μm PVDF滤器过滤至50ml圆底离心管中。 7. 4℃,50000g 高速离心2h,离心后可用记号笔对病毒沉淀做好标记 。 8. 小心弃去上清,晾干,按200ul /10cm培养皿的量加入DMEM(不含血清、双抗)或者PBS重悬病毒沉淀,室温静置2h,然后用移液器轻轻地吹匀(避免产生气泡),继续室温放置30min,按每次使用的病毒量分装到洁净的1.5ml EP管中,-80 ℃ 冰箱保存。
★ 慢病毒生物学滴度测定操作步骤:
1. 在滴度测定的前一天取一块48孔板,按照每孔3×104cells的密度接种HEK 293细胞。 2. 加polybrene到新鲜的完全培养基中(DMEM+10% FBS+P/S),使其终浓度为8ug/ml。 3. 用含有polybrene的完全培养基10倍梯度稀释病毒,具体做法如下:取一个96孔板,每孔含有90ul培养基,第一个孔加入10ul待测病毒原液,混匀后吸取10ul病毒混合液至第二个孔(混匀时尽量不要产生气泡),如此稀释至第六个孔(即稀释105倍)。
Titer
1ul
0.1 ul
0.01 ul
0.001 ul
0.0001 ul
Virus Stock
5 or 10
10
10
10
10
Medium with 8ug/ml polybrene
45 or 90
90
90
90
90
Load volume
10
10
10
10
10
4. 各吸取10ul病毒稀释液到相对应的48孔板中,置于37℃,5% CO2 培养箱培养过夜,16h~24h后用新鲜的完全培养基换液(DMEM+10% FBS+P/S)。 5. 置于37℃,5% CO2 培养箱培养48h后,用荧光显微镜计数荧光细胞数量(如果观察不清晰可以先用PBS(pH7.4)换液后再进行观察)。一般情况下,在最高稀梯度10m的孔数出现N(N<10)个带荧光的细胞,则病毒滴度为Nx10mTU/ul(10m为稀释倍数),即病毒滴度为Nx10m+3TU/ml,若N>10,则需要继续稀释。
★ 使用注意事项:
1. 需要使用去内毒素的质粒抽提试剂盒来抽提质粒,而且质粒OD260/OD280的比值在1.8~2.0之间。
2. 细胞生长状态对于病毒包装至关重要,因此需要保证良好的细胞生长状态和较少的细胞传代次数,细胞代数不要超过20代。
3. 在质粒转染时细胞培养基里面不要添加抗生素(如P/S、G418等)。
4. 病毒包装试剂盒应与HET高效转染试剂盒配套使用才能达到最佳的病毒包装效率;一般来说包装基因过表达的慢病毒其生物学滴度能够达到107~108TU/ml,而包装RNAi的慢病毒其生物学滴度能够达到108~109TU/ml。
5. 病毒切勿反复冻融,冻融次数尽量不要超过3次,每冻融一次大约有10%左右的病毒损失,应按每次使用的病毒量来分装然后冻存于-80度冻箱,保存时间尽量不要超过6个月。扣群交流198062731