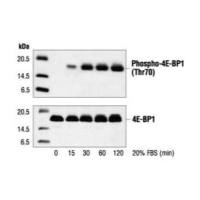
蛋白质印迹
互联网
印迹法(blotting)是指将样品转移到固相载体上,而后利用相应的探测反应来检测样品的一种方法。1975年,Southern建立了将DNA转移到硝酸纤维素膜(NC膜)上,并利用DNA-RNA杂交检测特定的DNA片段的方法,称为Southern印迹法。而后人们用类似的方法,对RNA和蛋白质进行印迹分析,对RNA的印迹分析称为Northern印迹法,对单向电泳后的蛋白质分子的印迹分析称为Western印迹法,对双向电泳后蛋白质分子的印迹分析称为Eastern印迹法。
蛋白质印迹法首先是要将电泳后分离的蛋白质从凝胶中转移到硝酸纤维素膜上,通常有两种方法:毛细管印迹法和电泳印迹法。毛细管印迹法是将凝胶放在缓冲液浸湿的滤纸上,在凝胶上放一片硝酸纤维素膜,再在上面放一层滤纸等吸水物质并用重物压好,缓冲液就会通过毛细作用流过凝胶。
缓冲液通过凝胶时会将蛋白质带到硝酸纤维素膜上,硝酸纤维素膜可以与蛋白质通过疏水相互作用产生不可逆的结合。这个过程持续过夜,就可以将凝胶中的蛋白质转移到硝酸纤维素膜上。但这种方法转移的效率较低,通常只能转移凝胶中一小部分蛋白质(10%~20%)。电泳印迹可以更快速有效的进行转移。这种方法是用有孔的塑料和有机玻璃板将凝胶和硝酸纤维素膜夹成“三明治”形状,而后浸入两个平行电极中间的缓冲液中进行电泳,选择适当的电泳方向就可以使蛋白质离开凝胶结合在硝酸纤维素膜上。
转移后的硝酸纤维素膜就称为一个印迹(blot),用于对蛋白质的进一步检测。印迹首先用蛋白溶液(如10%的BSA)处理以封闭硝酸纤维素膜上剩余的疏水结合位点,而后用所要研究的蛋白质的抗血清(一抗)处理,印迹中只有待研究的蛋白质与一抗结合,而其它蛋白质不与一抗结合,这样清洗去除未结合的一抗后,印迹中只有待研究的蛋白质的位置上结合着一抗。
处理过的印迹进一步用适当标记的二抗处理,二抗是指一抗的抗体,如一抗是从鼠中获得的,则二抗是抗鼠Ig G的抗体。处理后,带有标记的二抗与一抗结合,可以指示一抗的位置,即是待研究的蛋白质的位置。
目前有结合各种标记物的抗特定Ig G的抗体可以直接购买作为标记的二抗。最常用的一种是酶连的二抗,印迹用酶连二抗处理后,再用适当的底物溶液处理,当酶纯化底物生成有颜色的产物时,就会产生可见的区带,指示所要研究的蛋白质的位置。
在酶连抗体中使用的酶通常是碱性磷酸酶或辣根过氧化物酶。碱性磷酸酶可以将无色的底物5-溴-4-氯吲哚磷酸盐(BCIP)转化为蓝色的产物;而辣根过氧化物酶可以以H2O2为底物,将3-氨基-9-乙基咔唑氧化成褐色产物或将4-氯萘酚氧化成蓝色产物。另一种检测辣根过氧化物酶的方法是用增强化学发光法,辣根过氧化物酶在H2O2存在下,氧化化学发光物质鲁米诺(luminol,氨基苯二酰一肼)并发光,在化学增强剂存在下光强度可以增大1000倍,通过将印迹放在照相底片上感光就可以检测辣根过氧化物酶的存在。
除了酶连二抗作为指示剂,也可以使用其它指示剂,主要包括以下一些:
I125标记的二抗:可以通过放射性自显影检测。
荧光素异硫氰酸盐标记的二抗:可以通过在紫外灯下产生荧光来检测。
I125标记金黄色葡萄球菌蛋白A(Protein A):Protein A可以与Ig G的Fc区特异性的结合,因此Protein A可以代替二抗:I125标记的Protein A通过放射性自显影检测。
金标记的二抗:二抗通过微小的金颗粒包裹,与一抗结合时可以表现红色。
生物素结合的二抗:印迹用生物素结合的二抗处理后,再用碱性磷酸酶或辣根过氧化物酶标记的凝集素处理。生物素可以与凝集素紧密结合,这种方法实际上相当于通过生物素与凝集素的紧密结合将二抗与酶连接,通过酶的显色反应就可以进行检测。这种方法的优点是由于生物素是一个小分子蛋白,一个抗体上可以结合多个生物素,也就可以结合多个酶连接的凝集素,可以大大增强显色反应的信号。
除了使用抗体或蛋白作为检测特定蛋白的探针以外,有时也使用其它探针如放射性标记的DNA,可以检测印迹中的DNA结合蛋白。