多篇 SCI 发现用 RIPA 提蛋白存在问题,我们该如何应对?
英文特
这篇综述重点说明使用 RIPA 裂解液提取总蛋白以及下游实验中可能存在的问题。
RIPA 裂解液常用于从脊椎动物细胞和组织中提取总蛋白 [1]。但是由于蛋白质间有较大的差异和非蛋白成份的干扰,所以从一个样本中同时释放和溶解所有蛋白质是非常困难的。特别是一些整合到膜上的蛋白质,或与其他蛋白质 / 核酸形成复合物时,就大大阻碍了提取效率。
因此可以推断,蛋白质在提取过程中或多或少的与在体内时真实情况不尽相同。
经典 RIPA 裂解液中含有低浓度的十二烷基硫酸钠(SDS 变性剂),脱氧胆酸(干扰蛋白质间相互作用)及其他成分。
虽然 RIPA 裂解液经过不断改良使用,但是 RIPA 提取蛋白通常会产生两个不同的部分:即 RIPA 可溶组分和 RIPA 不可溶组分。 一般来说,只有 RIPA 可溶组分被用于下游实验,而 RIPA 不可溶组分被丢弃。这样提取的蛋白在使用中会存在哪些问题呢?
先来看些文献数据:
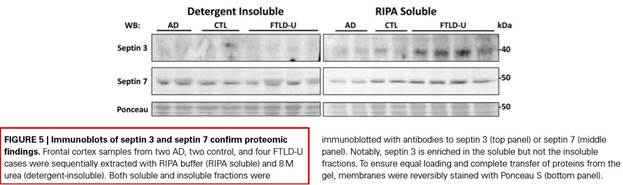
研究发现,不同的蛋白在 RIPA 裂解液中溶解性不同,例如 F9 中的纤维连接蛋白不溶于 RIPA 裂解液 [2] 。而小鼠额叶样品中在 RIPA 可溶组分和非可溶性组分中含有相同量的 Septin 7 [3](下图),表明用 RIPA 裂解液提取这些特定蛋白质的效率十分低。
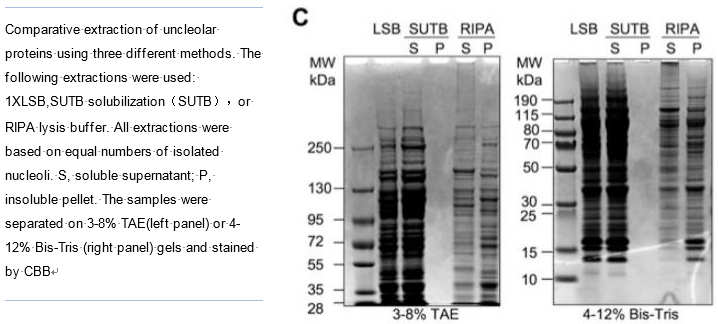
近年来,越来越多的研究者密切关注 RIPA 不可溶组分中的蛋白质组分,以及它们对下游实验和整体数据的影响。Bai 和 Laiho 用 RIPA 裂解液从 Hela 细胞核中提取蛋白,发现可溶性组分和不可溶性组。
分的蛋白质图谱差异很大,表明蛋白质的丢失不成正比 [4] (下图)。
Mukhopadhyay 等 [5] 从突变小鼠的乳腺上皮细胞中提取总蛋白,发现在 RIPA 不可溶组分中,通过 WB 很容易检测到 EGFR, HSP90, c-Src, 和 tubulin,表明这些蛋白在 RIPA 不可溶组分中大量存在(下图)。

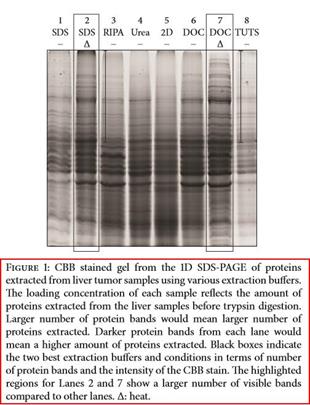
Wang 等 [6] 对比 SDS 加热法和 RIPA 裂解液法从斑马鱼肝脏肿瘤中提取蛋白,发现 RIPA 裂解液提取这些样品时对于大分子量蛋白的提取效率十分低(下图)。
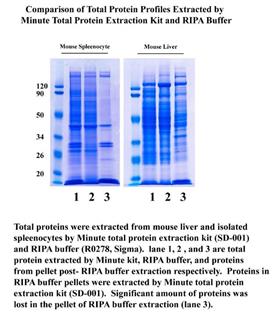
Li[7] 对比了从小鼠脾脏和肝脏中提取总蛋白 RIPA 可溶和不可溶性组分以及基于离心管柱法商业试剂盒提取的蛋白质图谱,发现 RIPA 不可溶组分蛋白质图谱与可溶性组分图谱相似,但是不完全相同。这些丢失的不可溶组分覆盖了整个蛋白质图谱分子量范围,不同样品的不可溶组分也有细节上的差异。
不同样品的蛋白质丢失是不可预测的。然而,商业试剂盒提取蛋白不产生不可溶组分,更快速,可获得更高产量更完整的蛋白质图谱(下图)。
Ngoka [8] 用质谱平行对比了几组乳腺癌 RIPA 可溶组分和不可溶组分的蛋白质图谱。结果发现,使用含尿素的裂解液提取 RIPA 不溶性组分中的平均分子量蛋白质含量比可溶性组分高 60% 。换句话说,许多大分子量蛋白质被丢失在 RIPA 不可溶组分中。
研究还表明,几乎所有的细胞外基质(ECM)和许多细胞骨架蛋白被发现在 RIPA 不可溶组分里。这些结果表明,由于蛋白丢失在不可溶组分中产生了偏差, RIPA 提取蛋白的蛋白质谱是不完全的。
利用 RIPA 裂解细胞后一个主要用途是进行目标蛋白的定性和 / 或定量分析 [9,10,11]。最近一篇综述报道了影响定量免疫印迹的关键因素 [12],在这项研究中,tubulin, lamin A, KRT5 显示大量丢失在 RIPA 不可溶组分中。
最值得注意的是,组蛋白 H3K4me2 发现仅仅存在于 RIPA 不可溶组分中。转录因子 GATA-2 和黏附分子β-catenin 也出现在不可溶组分中。研究中的另一个重要发现是样品制备方法对实验结果有显著影响。
Janes [12] 对比了 NP-40,RIPA 裂解液和 Laemmli 裂解液的作用,用 WB 检测切割形式的 caspase-8,发现使用 Laemmli 裂解液的样品中可以检测到,而使用 RIPA 裂解液样品中没有检测到,证实了 RIPA 裂解液不适合用于这类型的分析。
利用 RIPA 裂解液提取的蛋白还被发现会人为的增加了某些蛋白激酶的活性。
用 RIPA 裂解液裂解结肠癌细胞比用 NP-40 裂解后体外蛋白酶活性升高了 5-7 倍 [13]。Zapata[14] 等人,对比用 RIPA 和 2%SDS 提取活化的 T 淋巴细胞 caspase 的活性,发现 RIPA 裂解液通过释放 GraB 人工激活 caspase-3。这些结果强烈建议大家在使用 RIPA 裂解液时要做好应对数据解读的预案。
如上所述,使用 RIPA 裂解液提取总蛋白由于蛋白的丢失会产生很多问题。
就总蛋白而言,提取过程中
(1) 丢失的蛋白会引起蛋白图谱的变化
(2) 改变不同种类蛋白的比例
(3) 改变某些蛋白的活性。
下游实验中可能存在的问题:
(1) 使用 RIPA 裂解液提取蛋白做 WB 会人为的增强或降低某些信号强度。RIPA 裂解液提取蛋白已经被证实有 10-30% 的蛋白会丢失在不可溶组分中 [12]。
(2) 如果一个细胞 / 组织样品中某些特定的蛋白质可以在可溶组分和不可溶组分间转变,或者像上面所述受激活状态影响 [12] 的情况下,数据的解释可能成为一个大问题。
(3) RIPA 裂解液提取的蛋白不适合用于目标蛋白的定性和 / 或定量分析。
理想的总蛋白提取应该是什么样的呢?
(1) 获取给定样品中完整的蛋白质图谱,要真实的反映所有蛋白质种类和比例。大多数研究人员认为他们采用的总蛋白提取方法已经反映了体内目前的情况,但是很少有人真正的通过平行实验对比不同的提取方法。在许多情况下,很可能真实的蛋白质图谱和研究者相信的结果不完全相同。
(2) 获取最大的蛋白质溶解度,最少的蛋白质损失以及得到完整的蛋白质图谱才是蛋白质提取最佳的选择。
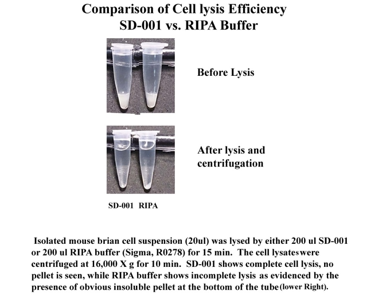
看了上面的种种问题,那么如今我们是否已有办法解决 RIPA 裂解液提取蛋白过程中存在的问题呢?答案是肯定的!您是否设想过有一天蛋白质提取也可以像核酸提取一样操作简单快速得率高?是的,Inventbiotech 公司把它变成了现实,来自美国专利技术离心管柱蛋白提取法,只需您加入裂解液,过柱离心,不产生不可溶组分,1 分钟轻松解决蛋白提取丢失问题。
参考文献
Alcaraz, C, et al. (1990) . Comparison of a radioimmunoprecipitation assay to immunoblotting and ELISA for detection of antibody to African swine fever virus. J. Vet. Diagn. Invest. 2:191-196
Grover, A., and Adamson, E. D. (1985). Roles of Extracellular Matrix Components in Differentiating Teratocarcinoma Cel. J. Biol. Chem. 260:12252-12258.
Gozal, Y. M. et al. (2011).Proteomic analysis of hippocampal dentate granule cells in frontotemporal lobar degeneration:application of laser capture technology. Frontiers in Neurology. Dol: 10.3389/fneur.2011.00024
Bai,B., and Laiho, M. (2012).Efficient sequential recovery of nucleolar macromolecular components. Proteomics . 2012 October ; 12(19-20): 3044–3048.doi:10.1002/pmic.201200071.
Mukhopadhyay, C. et al. (2016). Casitas B-cell lymphoma (Cbl) proteins protect mammary epithelial cells from proteotoxicity of active c-Src accumulation . PNAS 5:8228-8237
Wang, J. et al. (2015). Dramatic Improvement of Proteomic Analysis of Zebrafish Liver Tumor by Effective Protein Extraction with Sodium Deoxycholate and Heat Denaturation. Int. J. Anal.
Li, Q. (2016). Pitfalls of Protein Extraction by RIPA Buffer. Biotechniques. 61:327
Ngoka, L. CM. (2008).Sample prep for proteomics of breast cancer: proteomics and gene ontology reveal dramatic differences in protein solubilization preferences of radioimmunoprecipitation assay and urea lysis buffers. Proteome Science. 6:30 doi:10.1186/1477-5956-6-30
Guan, R. et al. (2014). A Novel Protein Is Lower Expressed in Renal Cell Carcinoma.Int. J. Mol. Sci. 15:7398-7408;doi:10.3390/ijms15057398
Cascio, S., and Finn, O. J. (2015). Complex of MUC1, CIN85 and Cbl in Colon Cancer Progression and Metastasis.Cancers. 2015, 7, 342-352; doi:10.3390/cancers7010342
Han, Y. et al. (2015). Expression and significance of annexin A2 in patients with gastric adenocarcinoma and the association with E‑cadherin . Exp. Thera. Med. 10:549-554. DOI: 10.3892/etm.2015.2565
Janes, K. A. (2016). An Analysis of Critical Factors for Quantitative Immunoblotting. Sci Signal. ; 8(371): rs2. doi:10.1126/scisignal.2005966.
Deseau, et al. (1987). Analysis of pp60 'lSrc Tyrosine Kinase Activity and Phosphotyrosyl Phosphatase Activity in Human Colon Carcinoma and Normal Human Colon Mucosal Cells. J. Cell. Biochem. 35:113-128
Zaptata, J. M et al. (1998). Granzyme Release and Caspase Activation in Activated Human T-Lymphocytes. J. Biol. Chem. 237:6916-6920


![[精选]SCI论文写作投稿资料包:100+资料& 投稿答疑30问](https://img1.dxycdn.com/p/s14/2023/1105/569/6102685706544601271.jpg!wh200)