双向电泳实验过程及相关溶液配置
互联网
一、实验原理:
2-DE的第一向电泳等电聚焦是基于等电点不同而将蛋白粗步分离,第二向SDS-PAGE是基于蛋白质分子量不同,而将一向分离后的蛋白进一步分离。这样就可以得到蛋白质等电点和分子量的信息。
二、实验步骤:
1.样品的溶解
取纯化后的晶体蛋白3.0mg,加入300μl裂解液(1mg蛋白:100μl裂解液)振荡器上振荡10min左右,共处理一个小时。其中每隔10~15分钟振荡一次,然后13200rpm离心15min除杂质,取上清分装,每管70μl,—80℃保存。
2.Bradford法测蛋白含量
取0.001g BSA(牛血清白蛋白)用1ml超纯水溶解,测定BSA标准曲线及样品蛋白含量。
取7个10ml的离心管,首先在5个离心管中按次序加入0μl,5μl,10μl,15μl,20μl 的BSA溶解液,另2管中分别加入2μl的待测样品溶液,再在每管中加入相应体积的双蒸水(总体积为80μl),然后,各管中分别加入4ml的Bradford液(原来配好的Bradford液使用前需再取需要的剂量过滤一遍方能使用),摇匀,2min在595nm下,按由低到高的浓度顺序测定各浓度BSA的OD值,再测样品OD值。(测量过程要在一个小时内完成)。例如:
编号 蛋白量(ul)Buffer(ul)Bradford(ml)OD595值
1 0 80 4 0
2 5 75 4 0.024
3 10 70 4 0.061
4 15 65 4 0.091
5 20 60 4 0.116
Bt4 2 78 4 0.079
Bt4 4 76 4
转Bt4 2 78 4 0.075
转Bt4 4 76 4
标准曲线方程式:Y= aX+b.其中Y为 OD值,X为蛋白含量。a、b通过作图输入数据可知
相关系数通过输入数据,作图,软件分析可得
OD值测量过程:
比色皿用70%的乙醇保存,待用时用双蒸水冲洗,再用无水乙醇冲洗,双蒸水冲洗,再加入待测样品溶液润洗,然后,加入样品,测定OD值。
3.双向电泳第一向---IEF(双向电泳中一律使用超纯水)
3.1 水化液的制备
称取2.0mg 的DTT,用700μl水化液储液溶解后,加入8μl 0.05% 的溴酚兰,3.5μl(0.5%v/v)IPG buffer (pH 3-10)振荡混匀,13200rpm离心15min 除杂质,取上清。
在含300μg 蛋白(经验值)的样品溶解液中加入水化液,至终体积为340μl,振荡器上振荡混合,13200rpm离心15min除杂质,取上清。
3.2 点样,上胶
分两次吸取样品,每次170μl,按从正极到负极的顺序加入点样槽两侧,再用镊子拨开Immobiline DryStrip gels (18cm,pH 3—10)胶条,从正极到负极将胶条压入槽中,胶面接触加入的样品。
注意:胶条使用前,要在室温中平衡30分钟;加样时,正极要多加样,以防气泡的产生;压胶时不能产生气泡;酸性端对应正极,碱性端对应负极;样品加好后,加同样多的覆盖油(Bio-Rad),两个上样槽必须与底线齐平。
3.3 IPG聚焦系统跑胶程序的设定(跑胶温度为20℃)
S1 (30v,12hr,360vhs,step)
S2 (500v,1hr,500vhs,step)
S3 (1000v,1hr,1000vhs,step)
S4 (8000v,0.5hr,2250vhs,Grad)
S5 (8000v,5hr,40000vhs,step)共计44110vhs,19.5小时
其中S1用于泡胀水化胶条,S2和S3用于去小离子,S4和S5用于聚焦
3.4 平衡
用镊子夹出胶条,超纯水冲洗后,在滤纸上吸干(胶面,即接触样品那一面不能接触滤纸,如果为18cm的胶条要将两头剪去),再以超纯水冲洗,滤纸吸干(再次冲洗过程也可省略),然后用镊子夹住胶条以正极端(即酸性端)向下,负极端(即碱性端)向上,放入用来平衡的试管中(镊子所夹的是碱性端,酸性端留有溴酚兰作为标记),用平衡液A,平衡液B先后平衡15min。注:平衡时要注意保持胶面始终向上,不能接触平衡管壁。
平衡第二次时,在沸水中煮Marker 3min,剪两个同样大小的小纸片,长度与一向胶条的宽度等同,然后吸取煮好的Marker,转入SDS—PAGE胶面上,保持紧密贴合;同样在第二次平衡时,煮5%的琼脂糖10ml。
4.双向电泳第二向---SDS-PAGE
4.1 配胶(两根胶条所用剂量)
分离胶:(T=8% 80 ml):溶液于真空机中抽气后再加APS和TEMED
30 % 丙烯酰胺储液 21.28ml
分离胶buffer 20ml 10%APS 220μl TEMED 44μl
双蒸水 38.72ml
浓缩胶:(T=4.8% 10ml)
30 % 丙烯酰胺储液 1.6ml
浓缩胶buffer 2.5ml 10%APS 30μl TEMED 5μl
双蒸水 5.9ml
4.2 灌胶
将玻璃板洗净后,室温晾干,然后,将电泳槽平衡好,玻璃板夹好,再在玻璃板底部涂上凡士林以防漏胶,倒入正丁醇压胶,凝胶后(这时会出现三条线),用注射器吸去正丁醇,超纯水洗两次,再用滤纸除水后,倒入浓缩胶,正丁醇压胶,凝胶后,用注射器吸去正丁醇,超纯水洗两次,再加入超纯水,用保险膜封好。
4.3 转移
剪两个小的滤纸片,吸取Marker后,放入SDS—PAGE胶面的一端。然后,将平衡好的IPG胶条贴靠在玻璃板上,加少量的5%的琼脂糖溶液在胶面上(琼脂糖凝胶在转移前十几分钟的时候配好,水浴加热溶解,并保持烧杯中水处于沸腾状态,至用之前再拿出来),再将IPG胶条缓缓加入SDS—PAGE胶面,其中不断补加5%的琼脂糖溶液,注意不能产生气泡。
4.4 跑胶
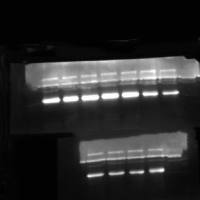
浓缩胶 13mA 分离胶 20mA 共约5.5个小时
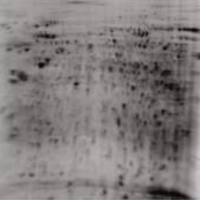
5.银染(两根胶条所用剂量)(银染特别注意用超纯水)
5.1 固定 30min 无水乙醇 200ml+乙酸50ml,用超纯水定容至500ml
5.2 敏化 30min 无水乙醇 150ml
Na2S2O3S226;5H2O 1.5688g
无水乙酸钠 34g
先用水溶解Na2S2O3S226;5H2O和乙酸钠,再加乙醇,最后定容至500ml
5.3 洗涤 5min × 3次
5.4 银染 20min AgNO3 1.25g 用超纯水定容至500ml
5.5 洗涤 1min × 2次
5.6 显影 无水Na2CO3 12.5g 用超纯水定容至500ml
甲醛(37%)0.1ml,临时加
5.7 终止 10min EDTA—Na2S226;2H2O 7.3g 用超纯水定容至500ml
5.8 洗涤 5min × 3次
注:整个双向电泳实验中全部使用超纯水,尽量减少离子的影响。
B. 实验相关试剂配制
1. Bradford 工作液
95%乙醇 25ml 先用乙醇溶解考马斯亮兰G250,溶解完后再加磷
85%磷酸 52ml 酸,最后超纯水定容至500ml。过滤后置于棕色瓶
考马斯亮兰G250 0.035g 外加油皮纸保存(Bradford不稳定,一周内有效)
2. 裂解液
尿素 8M
硫脲 2M
CHAPS 4%
DTT 60 mM
Tris—base 40 mM(如果有条件可以添加PMSF 0.5mM和5%的Pharmalate)
3.水化液储液
尿素 8M
硫脲 2M
CHAPS 4%
Tris—base 40 mM
4.分离胶buffer (pH8.8) 250ml
SDS 0.4% 1g
Tris—HCl 1.5M 45.4275g
5.浓缩胶buffer (pH6.8) 100ml
SDS 0.4% 0.4g
Tris—HCl 0.5M 6.07g
6.凝胶储存液(30%的丙烯酰胺)250ml
Acr 29.2% 73g
Bis 0.8% 2g
7.电极缓冲液(跑一次要配制2500ml)
甘氨酸 43.2g 36g
Tris 9g 或 7.5g
SDS 3g 2.5g
超纯水定容至3000ml 超纯水定容至2500ml
8. 0.5M Tris —HCl pH 6.8储液
6.1g Tris先用30ml超纯水溶解,再用46ml,3M HCl调pH6.8,再加水定容至100ml
9. 平衡液储液
脲(即尿素)36g
甘油 30% 30ml
SDS 1% 1g
0.5M Tris—HCl pH6.8 10ml 超纯水定容至100ml
10.平衡液A(一根胶条)
DTT 20mg
平衡液储液 10ml
11.平衡液B(一根胶条)
碘乙酰氨 300mg
平衡液储液 10ml
0.05%溴酚兰 15μl (平衡液A、B均需临时配制)
12.0.5%琼脂糖10ml
琼脂糖 0.05g
电极缓冲液 10ml
溴酚兰 25μl
补:4、5、6的溶液需过滤后储存于4OC备用。
C. 药品
CHAPS 兼性离子去垢剂 去垢剂可破坏蛋白质分子之间的疏水相互作用,
SDS 离子型去垢剂 提高蛋白质的溶解性,防止在等电聚焦时析出
尿素 离液剂 可改变或破坏氢键等次级键的结构,使蛋白质
硫脲 离液剂 变性并使蛋白失活。尿素和硫脲联合使用,可
以大大增加蛋白质的溶解性
DTT 还原剂 断裂蛋白质分子中Cys残基之间形成的二硫键,增加蛋白质的溶解性。但过分提高DTT的浓度,由于它pKa在8左右,因而会影响pH梯度。DTT在碱性pH下会去质子化,等电聚焦时会损耗,导致二硫键复原,蛋白质沉淀
BSA Bradford中制作标准曲线用
无水乙醇 和磷酸一起,提供Bradford中的环境
磷酸 提供Bradford中的酸性环境
Tris 构成缓冲液的成分,可用于抗衡pH的变化
IPG buffer
覆盖液 即矿物油,防止水分蒸发,样品干燥。
丙烯酰胺(Acr) 以丙烯酰胺为单体,甲叉二丙烯酰胺为交联剂,
甲叉二丙烯酰胺 (Bis)在催化剂(Aps)和引发剂(TEMED)作用下,聚合交联成三维网状结构
琼脂糖
溴酚兰 指示剂作用
碘乙酰氨(IAA)平衡液B中使用,中和A液中的DTT
正丁醇 比聚丙烯酰胺密度小,用于凝胶制作过程中的压胶
甘油 无机盐的良好溶剂,热稳定性好
Marker
考马斯亮兰G250(Bradford法用)考马斯亮兰G250有红、蓝两种不同颜色的形式在一定浓度的乙醇及酸性条件下,可配成淡红色的溶液,当与蛋白结合后,产生蓝色化合物,反应迅速而稳定,反应化合物在465~595nm处有最大的光吸收值,化合物颜色 深浅与蛋白浓度的高低成正比关系,因此可检测595nm的光吸收值的大小计算蛋白的含量
甘氨酸 与Tris构成缓冲系统
AgNO3
EDTA 金属螯合剂,可以结合银离子,终止银染过程。