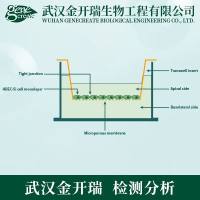
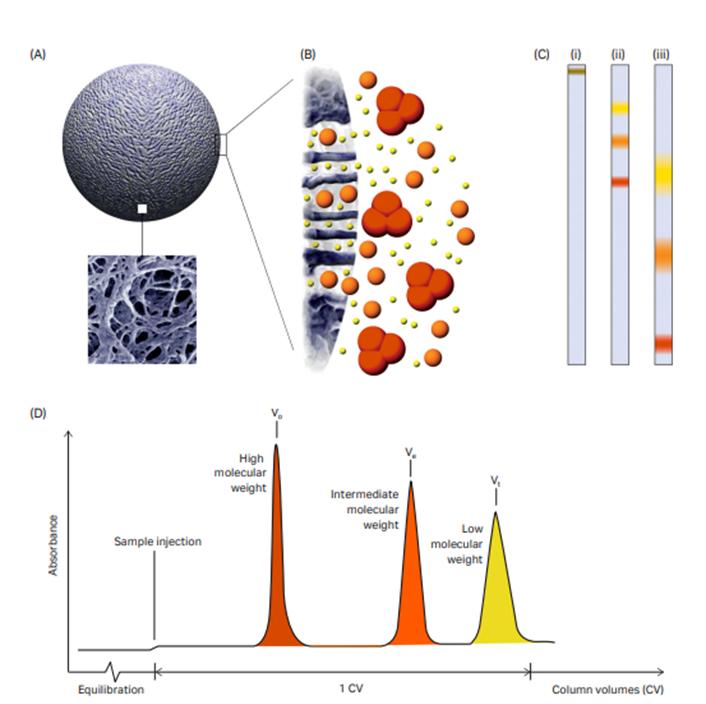
凝胶过滤实验方法
互联网
1.凝胶的选择
根据层析物质分子量的大小选择不同型号的凝胶,如除盐和除游离的荧光素,则可选用粗、中粒度的G25或G50,G250多用于分离蛋白质单体,G200多用于分离蛋白质凝胶聚合体等。
2.凝胶的预处理
称取适量的凝胶加入过量的缓冲液在冰箱(或室温)中充分膨胀,或在沸水中煮,膨胀时间应根据不同型号的凝胶而定。
凝胶量与型号和层析柱大小与规格及凝胶用量
| 层析柱规格& @- q1 P( c' ~undefined d | 凝胶的规格和用量(g) | |||||
| 直径(cm) | 高(cm) | 容量(ml)& L) Q+ ^/ `" i | G251 g. l% A5 @& s4 m" _0 ~undefined C | G50, k3 L) X! ?% Y- _. ~undefined A; f | G1000 K" k" G" q. ?: W+ ~ n | G200 |
| 0.9 | 15; N7 d) E3 u$ |8 t, d6 b$ R( x7 H8 { | 9.5 | 2.5 | 1 | 0.6( c, i" m, x; i2 p$ I# C3 B | 0.3 |
| 0.9 | 30/ p5 J5 L+ x, [& r+ A! R" T | 19" M! z+ undefined E' R0 Q6 b5 j | 5$ | 2 | 1.2 | 0.6' |
| 0.9 | 602 e$ x7 x+ H: s, { | 38. U: R7 D- Q8 _ | 10 | 4$ V/ ?- `1 G" |( F, | | 2.5 | 1.2 |
| 1.6$ \6 T# E! b5 r. J6 ^9 y" n | 20 | 40 | 10. Y8 s- V7 V) N/ d | 47 @) o3 u$ u" g$ y | 2.5+ v, _1 z( R# {, V& Y) Y, N# j7 ~ | 1.2 |
| 1.6 | 402 v2 G' J+ w$ {- O | 80 | 20 | 89 X. k" q' }, L4 e; ~undefined n0 { | 5.0( O# B$ D/ }2 F6 \) U! @ | 2.47 Q! `# r/ Q) _7 H# \ |
| 1.6 | 70 | 402 Y | 35 | 14 | 9.0. m# H$ W4 D0 i7 | | 4.4 |
| 1.6 | 100 | 2002 H. |- [% W5 S9 `& ] | 50 | 20 | 12.5 | 6( O3 w. n+ J; y |
| 2.6: T- v; ^) }- f& x | 402 Y# P! C2 u0 T. b2 ]4 V | 210 | 50 | 201 X7 P" u7 K) Q4 y( R5 c7 ~ | 12- ]% Q4 J2 {4 o) ?, C, r$ @ | 71 ~7 y$ p( T; r. ]: C |
| 2.6 | 70% c6 E: |$ H2 ~ ^7 M. f | 370$ s4 u s. f% b1 {0 z8 x | 90 y9 f2 k% j& e5 u | 35 | 20 | 128 Y. I: U& Y! _+ m( a7 C+ W |
| 2.6 | 100 9 a1 X/ v7 o! ]$ j9 Z: l | 530 $ Q c8 y1 o' W& g9 Y( s | 130 k8 i1 ]5 F: t0 g0 t) A | 50 ! D$ q$ f" Q# T: x | 30 1 D/ {; c7 k8 ?/ }# ^ | 17 . l! O6 G0 f, f# U8 k7 ` |
| 2.6$ ]7 o8 l' f- j; ^! W4 r4 z | | 601 G6 undefined w4 H) x n | 1000 | 2506 I, V$ G3 m1 |6 |' ] | 1101 l0 y& \# `; @2 X | 70) r2 W; A2 o3 W! [( ~undefined D: y J) o; [ | 35 |
为使粒子均匀一致需进行浮选,即加入凝胶粒子后,轻轻搅拌,静置20min,倾去沉淀的粒子,如此反复数次即可。
3.装柱
层析柱的选择一般根据分离样品的种类和样品的数量而定。纯化蛋白质时,柱床体积应为样品体积的25~100倍。去盐、游离荧光素约为样品体积的4~10倍。柱太短,影响分离效果。柱长一些,分离效果好,但柱太长,则延长分离时间,样品也稀释过度。
层析柱的内径也要选择适当。内径过细,会发生“器壁效应”,即靠近管壁的流速要大于中心的流速影响分离效果。所以层析柱的内径和高度应有一定的比例。对于除盐来说应为1:5~1:25;对于纯化蛋白质来说应为1:20~1:100。
4.加样与洗脱
样品体积不宜过多,最好为床体积的1%~5%,最多不要超过10%。样品浓度也不宜过大,浓度过大粘度大,分离效果差,一般不超过4%。
洗脱液应与膨胀一致,否则更换溶剂,凝胶体积会发生变化,影响分离效果。洗脱液要有一定的离子强度和pH值。分离血清蛋白常用0.02~0.1Mol/LpH6.9~8.0的PBS液(0.14Mol/LNaCl)和0.1Mol/LpH8.0Tris-HCl缓冲盐溶液(0.14Mol/LNaCl)。
5.洗脱液收集
利用自动分步收集器收集,并以20%磺基水杨酸测试,当蛋白液下来时,开始分管收集,至无蛋白液为止。
6.凝胶柱的重复使用与保存
当样品的各组分全部洗脱下来之后,即可加入新的样品,继续使用。保存方法有三种:
(1)在液相中保存最方便,即于凝胶悬液中加入防腐剂(如0.002%洗必泰)或高压灭菌后4℃保存。此法至少可以保存半年以上。
(2)用完后,以水冲洗,然后用60%~70%酒精液冲洗,凝胶体积缩小,即在半收缩状态下保存。
(3)长期不用者,最好以干燥状态保存,即水洗净后,用含乙醇的水洗,逐渐加大乙醇用量,最后用95%的乙醇洗,可全部去水,再用乙烯去除乙醇,抽滤干,于60℃~80℃干燥后保存。加乙醇时,切忌一上来就用浓乙醇处理,以防结块。