腺病毒载体介导的基因转移
互联网
6890
腺病毒载体介导的基因转移
腺病毒是一种双链DNA病毒,在自然界中广泛分布。尽管一些类型的腺病毒会引起人胃肠道、呼吸系统或眼部的急性感染,但是应用于基因治疗研究的腺病毒是安全的,对人无致病、致畸、致癌的潜在危害。
哺乳动物腺病毒的基因组DNA长约36kb,基因组的两端各有100―160bp的反向末端重复序列(inver tedterminal repeat,ITR)。腺病毒基因组DNA编码的基因主要有立早基因丘5A,迟早转录单位E1B、E2A、E2B、E3及E4,以及主要晚期转录单位L1~5。
E1区基因在病毒进入细胞核后立即活化,其编码产物是主要的转录调控物,调节所有的早期基因的功能;E2区编码腺病毒复制所必需的蛋白质;E3区编码与机体免疫识别有关的蛋白质,为相对非必需区,删去E3区对病毒感染没有明显的影响;E4区编码关闭宿主基因表达,使其有利于病毒繁殖的蛋白质,还可调节其他区基因的转录。
主要晚期基因的转录在DNA复制之后,起始于主要晚期启动子(MLP)处,产生各种顺式及反式转录本,随后通过剪切产生5种相同3’端的mRNA(L1―5)。所有L1~5转录本在其5’端均有一个由三联体组成的不编码氨基酸的前导链,即晚期转录本编码病毒颗粒装配所必需的结构蛋白。
基因治疗研究中应用最多的两个亚型是Ad―2和Ad―5。该腺病毒通过与靶细胞表面的受体结合进入细胞,与Ad―2和Ad―5感染直接有关的受体是柯萨奇―腺病毒受体(CAR),辅助受体有整合素及硫酸乙酰甘素糖蛋白等。
由于这些受体在除造血系统以外的组织和细胞中广泛分布和表达,故腺病毒可以感染的宿主范围也很广,既可以感染分裂期细胞,也可以感染非分裂期细胞,因而被广泛应用于肿瘤、心血管疾病及遗传病等分裂与非分裂细胞的基因传递。
据journal of Gene Medicine的统计,截至2006年,在全球1192项基因治疗临床试验方案中,有305项(26%)使用腺病毒载体,首次超过反转录病毒,居第一位。
由于腺病毒可以感染呼吸道和消化道,所以它所介导的基因治疗不仅可以静脉注射,还可以通过口服经肠道吸收或通过喷雾、滴注经呼吸道吸收,使得基因治疗易于推广应用。腺病毒易于制备、纯化和浓缩,病毒滴度可以高达1011
PFU/m1,比反转录病毒高出10 000倍以上。所以,它介导的基因治疗常采用in vivo的方式进行,是目前基因治疗临床试验中应用最多的一种载体。
腺病毒感染细胞时,由于病毒DNA不整合到染色体上,外源基因表达的持续时间较短,一般不超过1个月,但短期表达水平大大高于反转录病毒载体;腺病毒载体的装载容量也有限;低水平表达的病毒蛋白对宿主细胞毒性大,免疫原性强。
近几年来,人们对这种载体做了大量改造工作,主要集中在降低腺病毒载体的免疫原性,增加载体的包装能力,增加载体在靶组织中的扩散、感染和转基因表达水平,以及对靶组织或靶细胞的选择性感染能力等方面。下面就这方面的研究进展和成果作一简单介绍。
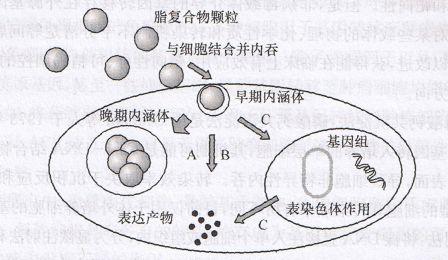
第一代腺病毒载体剔除了野生型腺病毒的n区和E3区基因。E1区基因是腺病毒复制必须的基因,而E3区基因在腺病毒产毒性复制中是非必需的。因此,这类腺病毒感染人体细胞后不能复制,而在体外制备和生产过程中缺陷的E1区基因由包装细胞HEK293反式提供,故又称复制缺陷型腺病毒。
这类腺病毒的包装容量大约在8.5kb以内。第二代腺病毒载体进一步剔除了野生型腺病毒的E2、E4基因,对HEK293细胞也作了一些改造。这种载体装载容量可增加至11kb,其细胞毒性和免疫原性都有所减弱,但基因转移和表达时间没有明显延长,且病毒载体滴度很低,只有第一代的1/10~1/100。
1996年以来出现的第三代腺病毒载体有了较大突破。考虑到腺病毒载体的弊病主要源于遗留在载体基本结构中的腺病毒结构基因,这一代载体己把它们全部去除,只保留了腺病毒必需的顺式作用元件即基因组两端的反向末端重复序列(inver tedterminal repeat,ITR)和包装信号序列,总长不到1kb。被去除的基因功能由辅助病毒通过反式作用来补偿。辅助病毒的包装信号被部分切除或插入外源序列以降低其包装效率。
辅助病毒DNA与带有目的基因的微小腺病毒载体(即第三代腺病毒载体)共转染HEK293细胞,包装成功后通过超离心分离辅助病毒和重组病毒。这种新型载体除保留了第一代载体的优点之外,新的优点是:容量很大,最高可达36kb,细胞毒性和免疫原性大幅减弱,而目的基因的表达时间则大大延长。
不足之处是:辅助病毒产量很高,分离困难,与重组腺病毒产量呈1:1的比例。
为了解决辅助病毒的问题,有实验室对微小腺病毒载体系统作了进一步改进。在这种载体系统中,辅助病毒的包装信号ψ的两侧装上了loxP位点,这样可在HEK293细胞中大量扩增,超离心纯化后感染已转移了微小腺病毒载体,且能组成性表达Cre重组酶的HEK293Cre4细胞,可以大量包装出微小腺病毒;
而辅助病毒自身由于带有loxP位点的包装信号ψ在Cre重组酶作用下会重组切除,因此,包装效率大大降低,最终在超速离心纯化后的病毒中含量不到1%。这一成果显示该系统在遗传病的基因治疗方面有着广阔的应用前景。
腺病毒载体的另一个重大改进是采用有复制能力的腺病毒。在基因治疗研究的初期,为了确保载体的安全性,都采用E1A、EIB基因缺失的复制缺陷型腺病毒作为载体。但随着腺病毒载体临床试验的广泛开展,人们增加了对该载体安全问题的了解。
实际上,复制缺陷型腺病毒载体在靶组织中的扩散、感染和转基因表达水平都较低,难以发挥优势,因此,人们开始探讨在肿瘤的基因治疗中使用条件复制型腺病毒代替复制缺陷型腺病毒。
目前肿瘤条件复制型腺病毒载体有两类:一类来自天然的突变株如Onyx―015,其E1B基因突变不能产生相对分子质量为55 000蛋白。EIB编码的相对分子质量为55 000蛋白产物可以拮抗正常细胞中抑癌基因p53编码的蛋白质产物的作用,促进腺病毒复制。
因此,Onyx―015在正常细胞中缺乏与p53蛋白抗衡的能力,不能复制。由于大多数的肿瘤细胞P53基因常常发生突变,在p53基因突变了的肿瘤细胞中,不需要EIB编码的相对分子量质为55 000蛋白产物拮抗p53基因的功能,腺病毒可以大量复制。除了EIB突变株外,目前还有E1A突变株。
另一类肿瘤条件复制型腺病毒载体,采用肿瘤细胞选择性表达基因的启动子调控腺病毒复制所需E1A或/和E1B基因表达,使腺病毒的复制局限在肿瘤细胞内。目前文献报道的启动子有端粒酶反转录酶基因启动子、甲胎蛋白基因启动子、前列腺特异抗原基因启动子、缺氧调控基因启动子等。
肿瘤条件复制型腺病毒载体的优势是,通过病毒载体的复制,使治疗基因拷贝数明显增加,治疗基因的表达水平也因此明显提高。此外,病毒复制可使肿瘤细胞裂解,杀伤肿瘤细胞。
肿瘤细胞裂解后释放出的病毒颗粒可以继续感染周围的肿瘤细胞,增加了病毒在肿瘤组织中的扩散和感染,被认为是肿瘤基因治疗最好的载体。目前利用肿瘤条件复制型腺病毒载体进行基因治疗已经成为了肿瘤基因治疗的新热点,Onyx―015已进入临床试验。
腺病毒依靠其表面的纤维与靶细胞膜上的受体结合进入细胞,由于受体分布广泛,故静脉注射腺病毒载体后常常造成广泛的非特异性感染。因此,有学者通过采用高分子化合物如聚乙二醇等修饰腺病毒载体,或在化学修饰时同时加入一些能与靶细胞特异结合的多肽或单克隆抗体等;有的则采用基因工程技术直接改造腺病毒纤维,使其不再与CAR结合,而与肿瘤细胞表面选择性表达的受体结合,提高腺病毒载体对肿瘤细胞的感染能力,并减少其对正常组织细胞的不必要的影响。
此外,不同的血清型对不同类型细胞的亲嗜性也不同。通过腺病毒外壳纤维改造以改变腺病毒对不同组织细胞的亲嗜性,也是腺病毒靶向性改造的重要内容,目前已成功包装出的外壳为35型、基因组为5型的嵌合型腺病毒,对造血干细胞的感染能力显著提高,扩展了腺病毒在造血系统及血液肿瘤中的应用。
鉴于腺病毒载体有上述优势,随着腺病毒载体改造的深入和成功,将在基因治疗中发挥更大的作用。