MTT实验两年心得
互联网
MTT实验是检测细胞活力的实验方法,由于细胞活力与细胞数呈正相关,因此也常常用来检测细胞的增殖情况。
MTT的原理:活细胞有琥珀酸脱氢酶,将MTT还原成棕褐色沉淀。由于一般介绍园子里已经很多,笔者将自己的心得按照实验流程与大家交流交流。
一、培养好细胞点板
养细胞没啥好说的,如果不知道细胞如何养,那就看看相关的文献方法。如果知道了细胞的名字,就可以去ATCC检索细胞的培养信息,这个网站上的培养方法是标准培养方法。当然可以根据自己实验要求进行修改。由于细胞计数很繁琐,点板时的细胞浓度是最难掌握的,这一点笔者的心得如下:
自己先将细胞养一段时间,大概了解细胞的增殖情况,在MTT检测时实际上要求细胞大概能长满96-孔板的80-90%,如果打算养48小时就检测,根据细胞的生长情况反推点板时的细胞浓度状况。
这时可以将细胞不进行计数,将消化好的细胞混匀后(可能是10 ml)直接在一个废弃(最好进行过无菌处理)的96孔板中依次加入180、100、50微升细胞,将细胞放置几分钟就会沉到板底了。
这时在显微镜下观察,推测哪个孔的细胞48 h能基本长满板底,假设50 微升的孔比较合适,而点板时没孔需点200 微升,那么就将细胞浓度再稀释4倍就可以正式点板了,这时顺便将细胞进行计数(因为实验记录要求写啊)。
这样就OK了!如果细胞还太多,将细胞稀释4倍后再重复以上操作。注意:不要过分信赖细胞计数,因为细胞计数的取样量为20 微升左右,由于颗粒的分布不均匀,代表性是很差的。建议:细胞计数一定要会,但不要完全依赖它。
点板时一定要将细胞消化成单个细胞,而且一定要混匀,最好用排枪,否则,MTT的SD会狂大!
二、点板布局
其实这一点很多人不懈一顾。如果你的细胞要养48 h或更长,建议不要吝啬96-孔板的四周边孔,这32个边孔不能使用,建议加入灭菌PBS以饱和中间64个孔的水分。因为细胞培养过程中,边孔的水分蒸发很快,培养液及里面的药物会出现浓缩现象,细胞的状况就复杂了,有些人称之为“边缘效应”这些孔的SD也会狂大,既然如此,不如不用。
三、加MTT
如果确认你考察的药物没有氧化还原性,你可以直接加入MTT溶液(总体积的1/10),如果你没有把握,建议在加MTT前换一次液;如果你肯定考察的药物的氧化还原性很强,比如谷胱甘肽、Vit E、VitC,那建议你用PBS将细胞洗洗,否则这些药物会将MTT还原成棕褐色沉淀,这种效果可能是你不需要的。
四、加入MTT后的反应
时间为3-4h,此时弃去各孔中的液体在加入200微升的DMSO。为了将沉淀溶解完全,尽可能将水弃除干净,加入DMSO后在摇床上震摇10min。
提醒:如果你的细胞贴壁不好,此时的沉淀在弃去液体时易丢失,因此贴壁不好的细胞在点板时记得将96孔板用多聚赖氨酸处理处理,要么在弃液体时先用甩板机离心,再轻轻弃去液体。关于DMSO的量,每孔的体积有点儿差异不干扰检测,只要能将沉淀完全溶解就行了。
至于DMSO的体积差异不同为什么不影响检测值已经被数学证明了,在此我不多说,如果有人不明白我再证明给他看。当然为了养成良好的实验习惯,DMSO的体积还是一致的好。
五、检测MTT
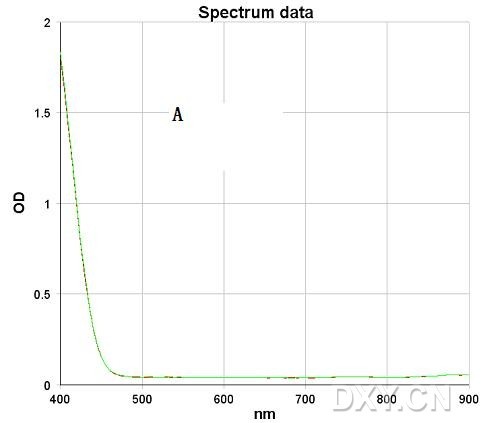
还原的MTT在460-630均有较好的吸收,如果你的酶标仪是滤光片,可以选470 nm左右或630 nm左右的滤光片,如果酶标仪有单波长,你可以在检测前扫描一下吸收谱,选用最大细说波长检测就是了,最大波长,大概在550 nm附近,必要时加一个参比波长以扣除非特异性吸收。
六、吸收值分析
在理想的MTT实验中,如果是细胞抑制实验,不加药物处理组的吸收值应该在0.8-1.2左右,太小检测误差占的比例较多,太大吸收值可能已经超出线性范围。这个原理在朗伯-比尔定律中有解释。
七、CCK-8实验
如果你觉得MTT中出现的问题不好解决,那么建议你做CCK-8实验,原理与MTT相似,但操作上简化些,当然,费用也稍微高一些。