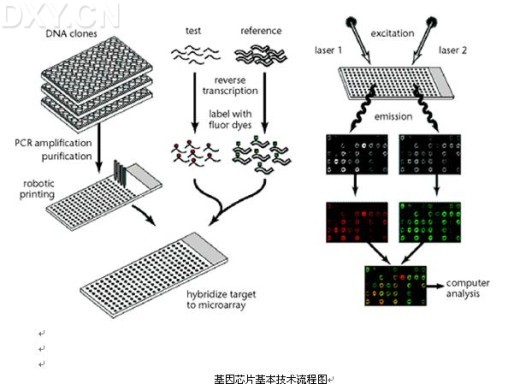
基因芯片实验原理与方法(二)
互联网
1、分别加入1/10体积3mol/l NaAc(pH4.5)和等体积5:1酸性酚氯仿溶液,冰浴20min 4℃,1100undefinedg,20min离心。
2、吸取上清至一50ml离心管,加入等体积异丙醇,混匀后-20℃放1小时。
4、 4℃,110undefinedg,20min离心,弃上清。
5、每管加入3毫升的溶液D,溶解沉淀,再用等体积的酚氯仿各抽提一次。
6、加等体积的异丙醇,-20℃沉淀2小时。4℃,1000undefinedg离心20min,弃上清。
7、加入10ml冰预冷的75%乙醇,洗涤沉淀2次,晾干沉淀。
8、溶解和比色
8.1、按照0.5ml/g组织的比例加入Milli-Q水200ml,彻底溶解沉淀。
8.2、取适量的样品用10mol/ml的Tris稀释一定倍数,测分光光度值。一般来说ratio(260与280的比值加320系数)值,在1.80—2.00之间比较好。
8.3、配1.0% 的胶,取500ng样品走电泳鉴定。
(一)mRNA的分离与纯化
1、称取一定量的oligo(dT)-纤维素,悬浮于1×上样缓冲液中。
2、将悬浮液装入填有经DEPC处理并高压灭菌的玻璃棉的1ml玻璃注射器中,柱床体积0.5-1ml,用10mlDEPC处理的水冲洗。柱床体积为1ml的oligo(dT)-纤维最大载样量为10mg总RNA,如总RNA的量较少,则应减少柱床体积。
3、用5倍体积的0.1mol/L的NaOH洗柱,然后再用5倍体积的ddH2O冲洗柱子。
4、用10倍床体积的洗脱缓冲液平衡柱子。
5、用10倍床体积的上样缓冲液平衡柱子,备用。
6、用ddH2O溶解RNA样品,68℃水浴3min后迅速插入冰浴中,加等体积的2×上样缓冲液,上样,然后收集流出液。
7、当全部溶液快流干时,将流出液置于68℃水浴3min后,迅速冷至室温后重新上样,并收集流出液。
8、用大量的1×上样缓冲液洗柱,直至OD260值很低或为零。
9、待上样缓冲液快流干时,加洗脱缓冲液洗柱,用1.5ml离心管分管收集,每管约400ul,共收集6管,通常mRNA洗脱峰集中在第2管中,第3管次之,第4管后就很少,而第1管中几乎没有RNA洗脱下来。
10、用分光光度计测OD260值,合并mRNA的洗脱组份。加入1/10 3mol/l NaAc(pH5.2)和3倍体积无水乙醇,混合后-80℃保存备用。
11、用时取出,4℃,12000r/min离心20min,弃上清,70%乙醇洗涤2次,沉淀中温烘干,备用。
(三)探针标记与纯化
1、将如下试剂混合:
17ul 25ug 总RNA或1~5 ug mRNA
1 ul RNasinRNasin核酸酶抑制剂
2 ul Oligo dT (2 ug/ul)
2、 加热到70℃ 10 min.,冰浴1 min。
3、 将如下试剂混合:
8 ul 5x RT buffer
4 ul DTT
1 ul dATP, dCTP, dGTP (各 25mM)
2 ul dTTP (2.5mM)
2 ul Cy3(对照组样本)1mM 或 Cy3-dUTP (实验组样本)1mM
4、 将上述混合液与RNA + oligo dT 液混合,振荡后冰浴,加入1.5 ul Superscript II。反转录酶,60℃孵育60 min 。
5、 加入1 ul 的Superscript II反转录酶,孵育30 min.后,冰浴1 min。停止反应。
6、 加入1 ul 的0.5M EDTA 和 2 ul 的 2M NaOH.,65℃加热10 min,水解除去RNA。
7、 加入4 ul的1M HCl 和 4 ul 1M Tris pH 8。
8、 加入17 ul的100mM 醋酸纳至各反应管。
9、 使用Qiaquick PCR purification kit纯化。
(四) 杂交及洗涤
1、将如下试剂混合
Cy5+Cy3 probe 30 μl
Poly d(A) (8mg/ml) 1 μl
Yeast tRNA (4mg/ml) 1 μl
Human C0t-1 DNA (10mg/ml) 1 μl
20x SSC 6 μl
50x Denhardt’液 1 μl
用microcon 30 filter 浓缩探针混合物,使终体积为12μl或略少
2、芯片先经含有0.5mg/ml鱼精DNA的杂交液在42℃预杂交6h。
3、杂交探针在95℃水浴中变性5 min,14.000 g 离心10min。
4、探针加在基因芯片的点样区域上,用盖玻片封片,置于42℃杂交15~17h。
5、用洗涤2×SSC+0.2%SDS冲洗玻片,去除盖玻片。
6、准备两个染色缸,分别装有2×SSC+0.2%SDS,0.1×SSC+0.2%SDS放入60℃水浴锅中。
7、将玻片依次浸入以上两个染色缸中洗涤10min。
8、再将玻片浸入装有0.1×SSC的烧杯中洗涤5min,晾干后扫描。
注意事项:每点的DNA的数量=样本的浓度 × 每点的量
斑点的容量少意味着用于杂交的探针的数量也很少,即使样本的浓度很高。必须努力减少这样的限制。一些因素必须考虑到,除了探针DNA的数量外,还有与目标分子相互补的探针DNA的比例,长短,目标分子的活性,就象用于检测信号方法的灵敏度影响着信号的强度。
杂交信号的浓度是与目标分子活性成比例的,与它的长度成反比,因此目标分子的特殊活性是十分重要的。每次实验的杂交时间也应该精确测量。
(五)图像处理与数据分析
用ScanArray 3000扫描芯片,用Genepix软件分析荧光信号强度, 为了避免信号值过低带来误差,只有那些Cy3或Cy5大于800的点被选出进行后续分析,并根据软件提供的校正系数对整张芯片的荧光信号值进行校正。 对于芯片上各点都采用Cy5/Cy3的比值作为ratio值,ratio值大于2.0或者小于0.5的点被认为是有表达差异的基因,利用芯片上点的管家基因的信号强度值校正芯片之间的差异。使用各种统计软件进行聚类分析等。
主要参考文献:
1、A Concise Guide to cDNA Microarray Analysis ,The Institute for Genomic Research
2、MicroArray Protocol ,HuGEIndex.org)
3、cDNA Microarray Protocol ,National Human Genome Research Institute, NHGRI
4、Duggan DJ, et al.Expression profiling using cDNA microarrays.Nat Genet 1999 Jan;21:10-4
5、Churchill GA.Fundamentals of experimental design for cDNA microarrays., Nat Genet 2002 32 .490-5
6、斩连群等 基因芯片技术与微生物学 微生物学免疫学进展 2002 Vol 30(1) 85-89
7、马立人等 《生物芯片》 化学工业出版社 2002