有图有真相,专业技术工程师带你一起轻松玩转 ChIP 实验
CST中国(Cell Signaling Tech
染色质免疫沉淀(Chromatin Immunoprecipitation, ChIP)是研究细胞内 DNA 与蛋白质相互作用的经典技术,特别是经常用于研究某些转录因子与特定基因组区域(如启动子或其它 DNA 结合位点)的结合,或者用来评价基因组特定位点的组蛋白修饰水平。
CST 推出的 SimpleChIP® 酶解法试剂盒有 9002,9003,9004 和 9005均含有标准 ChIP 流程所需的整套试剂、阳性对照组蛋白 H3 抗体、阴性对照 IgG、人和鼠 RPL30 阳性引物引物和 ChIP 级蛋白 G 琼脂糖微珠或蛋白 G 磁珠等,方法简便易行,与 CST 多种高质量的 ChIP 级抗体配合使用,将使您的 ChIP 实验质量提升到一个新的高度。
ChIP 概况图解:

在 ChIP 实验中,染色质样品的制备最为关键。
为了让您能够更直观地看到酶解法 ChIP 染色质样品的制备过程,我们将 CST 技术工程师最近与客户一起进行的标准 ChIP 实验样品制备的关键步骤给您呈现,希望我们能够带你一起轻松做好 ChIP 实验。
接下来全部真实记录:
时间:2016 年 3 月 8 日(看这个日子选的)
地点:清华大学生物医学馆
人物:

左)CST 技术工程师李博士;右)清华大学某实验室苏博士(此处为实验掠影)晴朗的一天,按照约定的时间,我们如期而至。这次我们使用的 SimpleChIP® 酶解法试剂盒货号为 9003,专门用于细胞样品,所配套的 protein G 微珠为磁性微珠。
实验设计如下:
阴性对照(IgG)管 1 个,目的抗体(TCF4)管 1 个,阳性对照(组蛋白 H3)管 1 个因此,此次实验后续有 3 个 ChIP 反应,按照试剂盒的细胞数要求,每一次 ChIP 实验约需要 4×106 个细胞。
考虑到我们后续还要对酶切用量进行优化,实际准备了足量细胞(每组约 1.5×107 个细胞)。在我们实验前,我们仔细观察了细胞的状态和密度,细胞状态很健康,贴壁良好,也达到了 80% 左右的汇合率,一切都符合 ChIP 实验的要求。
拿出试剂盒,我们首先对各种标配试剂置于冰浴中进行了标记。

由于试剂盒标配的 DTT 为干粉,因此我们需要配制 1M DTT 溶液(具体地,192.8 mg DTT#7016 加 1.12 ml dH2O,确保 DTT 完全溶解)。
然后,我们取出并室温预热 200X 蛋白酶抑制剂混合物 PIC#7012 和 10X 甘氨酸溶液#7005,直到完全溶解。
配制 ChIP 样品制备所需要的各种试剂:
包括:
缓冲液 A(主要是对细胞膜进行裂解,同时对核膜进行打孔,以便于后续微球菌核酸酶进入核内发挥酶解作用):我们按照实验设计,需要配 3 倍反应需要的体积,同时加入合适的 DTT 和 200X 蛋白酶抑制剂混合物(PIC),在冰上预冷。
按照说明书的描述,每 4X 106 细胞,准备 1 ml 1X 缓冲液 A(250 ul 4X 缓冲液 A #7006+750ul 水)+ 0.5 ul 1 M DTT + 5 ul 200X 蛋白酶抑制剂混合物(PIC),冰上预冷。因此,我们就把所有体积乘以 3,来配制啦,简单的算术题。
缓冲液 B(微球菌核酸酶的酶切缓冲液):我们按照实验设计,配了 3 个反应需要的体积,同时加入合适的 DTT(此处我们牢记不能加蛋白酶抑制剂混合物 PIC!!!)。
其他:找到固定细胞用的分子生物学级别的 37% 甲醛溶液(我们用的是 SIGMA 生产的 F8775);准备足量预冷的 PBS,用于洗涤细胞;再把离心机也调到 4 度预冷。
一切妥妥的,正式开始实验!
我们先在培养基中直接加入 37% 甲醛溶液 0.27 ml,使终浓度达到 1%(因为当时我们每盘细胞的培养基都是 10 ml,所以加入的甲醛溶液体积为 10 ml/37=~0.27 ml)。加入甲醛后,立刻将培养皿在摇床上室温缓慢摇动 1 分钟(确保彻底摇匀甲醛),然后静置 9 分钟。
接着,迅速在每个盘子里加入 1 ml 10X 甘氨酸溶液,在摇床上室温缓慢摇动孵育 5 分钟,以终止上述固定反应,这个时候你会看到培养基变色了。
由于我们使用的是贴壁细胞,所以接下来直接弃去每个盘子里的上清,然后迅速用 2 ml 预冷的 PBS 洗涤 2 次。
然后,我们加入 2 ml 含有 PIC 的 PBS,用细胞刮把每盘里的细胞全部刮下,可以重复加入含有 PIC 的 PBS,直到绝大部分细胞都被刮下,并将实验组和对照组的细胞分别汇集到 15 ml 离心管中。4°C,1500rpm 离心 5 分钟收集细胞,去除上清后立即进行后续的细胞核处理和染色质剪切。
我们先在离心管中,分别加入缓冲液 A,并用振荡器在合适的振荡频率将所有细胞重悬并混匀细胞悬液,不能有明显的细胞团块。

然后冰上孵育 10 分钟,每隔 3 分钟用振荡器混匀一次。
4°C ,3000 rpm 离心 5 分钟以沉淀细胞核。弃上清,并加入含有 DTT 的缓冲液 B 。这个时候你会发现细胞核不太容易重悬,最好用剪去前端部分的 1 ml 枪头吹打数次进行混匀。
再次离心,弃上清,并将沉淀用 300 ul 含有 DTT 的缓冲液 B 再次重悬,并将实验组和对照组细胞核样品分别转移到一个新的 1.5 ml 离心管中。此时,我们已经为后续酶切提供了一个合适的缓冲液体系。
虽然试剂盒推荐微球菌酶的一般起始量为 0.5 ul/每 4X 106 细胞,但因为我们仍然想优化一下酶切条件,找到最适的用量。因此,我们将细胞核提取物一分为 3,进行了一个梯度实验。即分别加入 0.5ul,1ul 和 1.5ul,来检测一下酶切效率。
加入不同量的微球菌酶后,37°C 孵育 20 min,每隔 3~5 分钟混匀一次。
然后每管加入 10 ul 0.5 M EDTA 终止消化,将离心管置于冰上。
4°C 13000rpm 离心 1 分钟,沉淀细胞核,弃上清。
然后将每管细胞核沉淀重悬在 500 ul 1X ChIP 缓冲液 + PIC 中,冰上孵育 10 分钟。这个时候我们用带有剪去前端部分的枪头的移液器吹打均匀。
注意了,接下来要对细胞核样品进行短暂超声了,很多第一次用这个试剂盒的同学表示不明白了,为什么又要超声咧?不是说酶解法不需要超声了吗?
小伙伴们,此处超声是别有用意的,它可以彻底破碎酶切后细胞核样品中残留的核膜,让染色质充分释放到 ChIP 缓冲液中。因为我们前面的缓冲液 A 仅仅是将核膜打了孔,并没有完全裂解,短暂的超声还是非常必要的。
为了让大家更好的看到超声装置的实际情况,我们把我们当时自制的一个冰水混合体系给您秀一下。


我们使用最大功率为 100W 左右的超声破碎仪进行超声处理,使用 3 mm 的探头,设置超声功率为最大功率的 30%~40%,对细胞核进行每次 20 秒,共 3 次(累计 60 秒超声)的超声处理以达到完全破碎的效果。每次超声处理间隔 30 秒并置于冰上以防止超声引起样品过热。我们按照预定调节设定了程序,然后就如法炮制,一切 okay!
4°C, 10000rpm 离心 10 分钟,除去样品中的细胞核碎片,分别将上清转移到一个新管子中,即为交联的染色质样品。然后我们分别取出 50 ul 染色质样品用以分析 DNA 的酶切情况。
对分出的 50ul 样品,我们按照标准的解交联和 DNA 纯化步骤回收了其中的 DNA 样品,一部分进行了 DNA 浓度测定,然后将剩余的 DNA 样品利用 1% 的琼脂糖电泳进行分离检测,如下图所示:
Lane 1:0.5ul
Lane 2:1.0ul
Lane 3:1.5ul
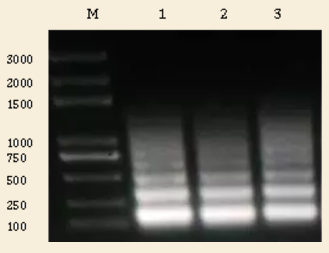
从上图我们可以看出,微球菌酶切后,染色质 DNA 的分布主要是在 150,300,和 500bp 左右,但由于 2 号泳道的样品在 1000bp 以上的片段切割的更加充分(没有太多信号),所以我们决定利用 2 号泳道对应的染色质进行后续 ChIP 实验。
由于时间问题,后续实验是苏博士单独完成的,他后来按照标准的实验流程顺利完成了实验,初步的预实验结果如下图所示:
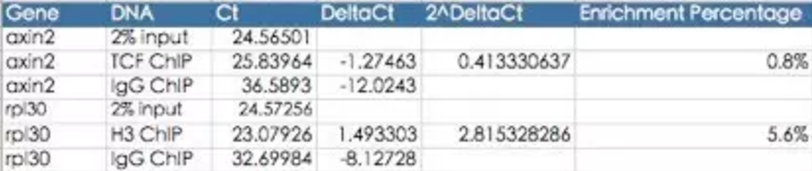
这和实验报道以及我们内部实验结果都是一致的,现在苏博士正在进行后续规模化的实验。