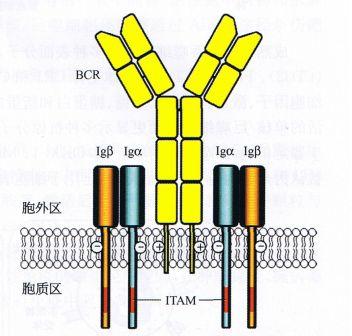
B细胞抗原结合导致的受体交联启动信号传导
互联网
B细胞识别抗原后所启动的信号转导与T细胞十分相似,首先通过受体分子的交联成簇启动信号的跨膜传导,但两者启用的机制不同,因为B细胞可以识别完整的、具有多个表位的抗原分子而不是经由MHC分子提呈的抗原片段。
抗原分子本身就可以通过表位与多个BCR结合,或如前所述借助抗原-补体复合结构同时结合BCR及CD21分子(BCR-Ag-C3dg-CD21),使B细胞表面多种参与抗原识别和信号转导的跨膜分子发生多聚作用,包括BCR-Ige/Igp、辅助受体(CD2l、CDl9、CD81)以及CD45分子。
这一点,和T细胞识别抗原时发生TCR-CD3、辅助受体(CD4/CD8)和CD45的多聚作用十分相似。
多聚化产生两个结果:一是CD45分子胞内段的PTP解除PTKSrc分子C端对PTK分子活性中心的抑制;第二个结果是,受体相关性蛋白酪氨酸激酶即Src家族的成员彼此成簇而发生相互磷酸化,SrcPTK因而激活。
表10-1表明,B细胞中参与这一重要步骤的Src家族成员有Lyn、Fyn、Blk和Lck,比参与丁细胞激活的Src家族多了两个成员。
有一个简单但很说明问题的实验,可以表明受体交联对于B细胞激活的重要性。分别用抗BCR抗体的Fab片段或F(ab)2片段处理B细胞。Fab因为是单价,不能交联BCR,故不能刺激B细胞活化。
F(ab)2可分别与两个BCR分子结合而使之交联,B细胞可有微弱的激活。如果再进一步用抗F(ab)2抗体,通过与两个F(ab)2结合而使更多的BCR交联,则B细胞可获得很强的激活信号。显然,此处实施交联的是抗BCR抗体及抗抗体,而抗原对B细胞激活中发生的是抗原分子或相关复合结构对BCR的交联。
信号转导的启动也与细胞膜上一种称为脂筏的特化微结构域有关。B细胞静止时脂筏中BCR分子很少,但B细胞接触抗原后可大量出现。当B细胞表面BCR发生交联时,相关跨膜分子往往聚集在脂筏中,并以此募集其他一些与信号转导有关的蛋白激酶和衔接蛋白如Syk、Btk、Vav、SHIP、PLC-y、P1 3K和BLNK等。
因此脂筏结构可通过接纳各种受体及信号分子,并协调它们之间的相互作用,积极参与信号转导。