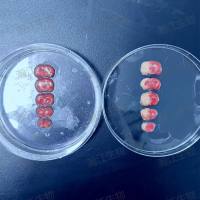
固定蠕虫的油红染色
互联网
3768
一、材料与试剂
1. 20%多聚甲醛
2. Na2EGTA
3. 三盐酸亚精胺
4. 亚精胺
5. 1,4-哌嗪二乙烷磺酸钠pH7.4
6. β-巯基乙醇
7. 油红
8. 异丙醇
9. 二硫苏糖醇
10. 0.2 μM 过滤器
11. Tris碱
12. 盐酸
13. PBS
14. 琼脂糖
15. 氯化钠
16. 氯化钾
17. Na2HPO4·7H2O
18. KH2PO4
19. NaOH
二、设备
1. EppendorfThermomixer混合器
2. 台式离心机
三、步骤
1. 使用1×PBS收集所需生长时期的蠕虫,转移到15 ml 锥形管中。如果使用的是成虫采用重力法收集或是幼虫期蠕虫采用在1 000 g 减慢旋转30秒。
注意:确保收集足够的(~200-500)蠕虫因为在这个过程中将丧失一些蠕虫。
2. 吸出上清,用10 ml 1×PBS洗涤,采用步骤1中的重力收集法或是减慢旋转收集法。
3. 二次洗涤之后,弃大部分上清剩余400 μl 并转移到1.5 ml Eppendorf管中。
4. 固定。加入500 μl 2×MRWB(新鲜配制)和100 μl 20%多聚甲醛到含有溶解于1×PBS的400 μl 样品的管中。轻柔的颠倒管混匀溶液,室温下固定30分钟,同时在EppendorfThermomixer混合器上轻柔的摇晃(x1000 rpm)(每5~8分钟颠倒管无需摇晃)。
5. 使用1 ml Tris-Cl缓冲液冲洗二次(100 mM,pH7.4)。在这二次冲洗之间,台式离心机在1,500 g 下减慢旋转30秒。
6. 在第二次冲洗之后,弃上清留下100 μl,加入900 μl 还原缓冲液[100 mM Tris-Cl pH7.4,10 mM DTT(1.54 mg in 1 ml)]。轻柔的颠倒混合管,室温下轻柔的摇晃还原30分钟。
7. 1 500 g 下离心30秒沉淀蠕虫。
8. 利用500 μl 1×PBS洗涤并于1 500 g 减慢旋转30秒。
9. 吸出上清至管中剩余300 μl,加入700 μl 异丙醇,轻缓的颠倒混合管,置于室温下轻柔的摇晃15分钟。
10. 在1 500 g 转速下减慢旋转30秒收集。
11. 吸出所有异丙醇,加入油红染料溶液。
12. 油红染液的制备:0.5 g 油红溶解于无水异丙醇中。室温下通过搅拌溶解平衡染液二天。
13. 使用前15分钟,4体积的双蒸水和6体积的染液溶液混合,室温下放置15分钟。混合液显现出雾状。
14. 使用0.2μM孔径大小的过滤器过滤溶液,过滤液应该是清澈透明的。
15. 加入1 ml 60%过滤染液至蠕虫中。室温下置于Thermomixer混合器中(×700 rpm 摇晃或是转子旋转)过夜。
16. 在1 200 g 下减慢旋转30秒沉淀蠕虫。
17. 吸出尽可能多的染液,并用1×PBS洗涤一次。
18. 直接利用琼脂糖垫将蠕虫固定在载玻片上(2%1×PBS溶解的琼脂糖)
注意:保持载玻片在湿度容器中以防止样品干燥。