膜蛋白的分离、鉴定及其功能分析—GFC/IEC/SDS-PAGE 和 MALDI-TOF-MS 方法
丁香园
3274
1. 前言
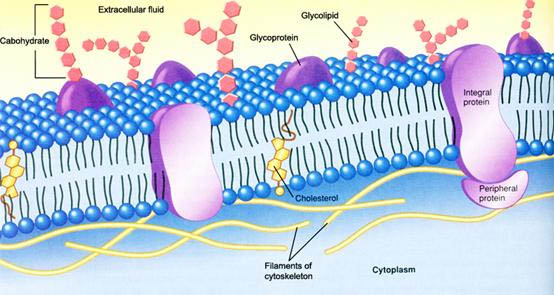
植物模式基因组测序和功能鉴定的研究成果以及快速增长的许多植物序列的数据 [1,2 ] ,使得用基质辅助激光解析飞行时间质谱(MALDI -TOF- MS ) 获得的肽质量指纹谱来鉴定蛋白质变得轻而易举。这种方法具有高灵敏度、高通量和低成本特点,但需要前期的蛋白质分离。由于膜镶嵌蛋白质在第一相的等电聚焦 (IEF ) 电泳中沉淀,目前最常用的以高分辨率解析从细胞中提取的蛋白质的二维凝胶电泳技术还不适于完全分离膜蛋白质组 ( 见第 11 章),相比之下,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳可有效分离膜镶嵌蛋白质。
下面要介绍的方法是以离子交换层析替代 2D-GE 电泳中 IEF,如果样品量充足,还可以辅以凝胶过滤色谱层析 [7] 。最终用 SDS-PAGE 电泳进一步分离膜镶嵌蛋白质。经过上述这些分离过程,许多膜镶嵌蛋白的胶内酶解和 MALDI-TOF/MS 分析获得了成功。
这个方法的目标之一是在一个单一的实验构架内,分离膜组分中不同类别的蛋白质,包括大部分的疏水、酸性和碱性蛋白。它们可通过染色胶和 MALDI-TOF/MS 蛋白质指纹谱进行蛋白质分析。本章节介绍的方法可能不能直接应用在其他材料上,但这些方法可以为读者在进行其他材料的实验过程中提供优化指导。
2. 材料
( 1 ) 分离缓冲液:5 mmol/L BTP-MES ( pH 7. 5 );0.2 mol/L 碘化钾, 1 mmol/L Na2EDTA,0.3 mol/L 甘露醇, 20% ( m/m) 甘油,5 mmol/L 二硫苏糖醇(DTT ) ,0.5% (V/V) 蛋白酶抑制剂混合物(Sigma 公司)和 15 mmol/L n-辛基-β-D-吡喃葡萄糖苷。
( 2 ) 增溶缓冲液:5 mmol/L BTP-MES ( pH 7.5 ),20% (m/m) 甘油和 0.5%(V/V) 蛋白酶抑制剂混合物(Sigma 公司)。
( 3 ) 洗脱缓冲液:3 mmol/L BTP-MES ( pH 7.5 ) ,1.5 mmol/L 十二烷基-β-D-麦芽糖苷(DM ) 和 20% 甘油(m/m) 。
( 4 ) Laemmli 样品缓冲液:4% ( m/V ) 十二烷基磺酸锂,20% ( m/m ) 甘油,10%(V/V) 2-巯基乙醇(2- ME) , 0.004% ( m/V ) 溴酚蓝,0.125 mol/L Tris-HCl,pH 6.8。
( 5 ) 胶段冲洗缓冲液:25 mrnol/L 碳酸氢铵,乙腈 50% ( V/V ) 。
( 6 ) 酶解缓冲液:15 mmol/L 碳酸氢铵。
( 7 ) 肽抽提缓冲液:乙腈 60% ( V/V ) ,0.15% ( V/V ) 三氟乙酸(TFA ) 。
4. 注释
( 1 ) 在分离膜蛋白时,还没有理想的方法彻底去除包覆亲水性蛋白和膜外周蛋白,使用亚临界胶团浓度的去垢剂打开膜蛋白微囊可能会不恰当地去除膜镶嵌蛋白质。判断膜分离过程的好坏,需要鉴定被去除掉的蛋白质。另外,如果无法去除膜外周蛋白质,那就跳过膜分离步骤,直接应用图 22-4 和 图 22-5 中表示的连续两步色谱层析(先是 GFC,然后是 AEC ) [7]。
( 2 ) 膜蛋白增溶是一步值得花时间仔细优化的实验步骤,首先,DM 已经被越来越广泛,而且也越来越成功地应用于增溶不同生物材料中具有功能活性的膜蛋白 [ 8,9] ,因此 ,它常常被推荐用做第一个测试实验。第二,DM/蛋白质的比例以及低速搅拌的增溶时间都需要进行优化实验。有时候在充满氩气和密封管子里的蛋白质混合物经过剧烈的涡旋振荡后可得到更高的增溶产率。
( 3 ) 应当通过预实验测试不同离子交换树脂对实验材料增溶蛋白质的分离效率,特别要比较层析柱结合蛋白质的容量和盐梯度洗脱结合在柱子上的蛋白质的能力。这里所用的膜材料,可被阳离子交换剂不可逆结合,所以最好使用阳离子交换剂(能洗脱出来 95% 的柱结合蛋白)。
( 4 ) 在 pH 7.0 条件下加样,约有 80% 的增溶蛋白质结合在 Mono Q HR 5/5 层析柱上(Amersham Biosciences 公司),增加样品加样缓冲液的 pH ( 最大可达 11) ,能提局蛋白质的柱结合率(最大可达 100%)。
( 5 ) 使用温和去垢剂增溶膜蛋白时,个别蛋白质可能会形成小的胶团,而超分子蛋白复合物可能会形成较大的胶团。若要估算胶团的大小,就需要取小样进行 GFC 色谱层析预实验,使用低样品进样量和宽分离范围的层析柱,如 Superose 6 10/30 ( Pharmacia/ Amersham Biosciences 公司), 这样可以让我们在以后的实验中选择更加合适的层析柱(具有较窄的分离范围、较强的分离能力以及较大的样品进样量)。
( 6 ) GFC 组分必须含有足够量的蛋白质(一般要 0.5 g 蛋白质),以保证第二级的 AEC 色谱层析和最后的 SDS-PAGE 电泳分离。
( 7 ) 防止胰蛋白酶的自身消化,对于有效消化蛋白质、在 MALDI-TOF 质谱上主要含胰蛋白酶消化肽以及减少其他肽段的信号来说,是非常重要的。为此我们必须做到以下几点:① 避免使用过量的胰蛋白酶,以上实验方法中介绍的胰蛋白酶使用量可以考虑为 7X2 mm、中等强度考马斯亮蓝染色的胶粒所需的最大量;② 尽量减少胰蛋白酶溶液的使用量,保证在 37°C 温浴之前的胶粒完全吸收胰蛋白酶溶液后,仅有一薄层胰蛋白酶溶液包裹着胶粒。注意之前提到的,在浓缩过程中,千万不要让含肽的溶液完全干燥。
( 8 ) 经过几十次激光轰击后,图谱质量常常变化很大,这似乎是膜蛋白肽段的特征,这意味着在介质表面的激光剥蚀和“ 易飞行”肽段的激光解析后,其他肽段能被进一步解析和离子化。因此,加和更多的质谱图谱(可多达 300 次激光轰击)将会带来更好的效果。
参考文献
1. G o d o v a c - Z i m m e r m a n n , J. and Brown, L. R. (2001) Perspectives for mass spectrometry and functional proteomics. Mass Spectrom. Rev.20, 1-57.
2. Rappsilber, J., Moniatte, M., Nielsen, M . L., Podtelejnikov, A.V., and Mann, M .(2003) Experiences and perspectives of M A L D I M S and M S / M S in proteomicresearch. Int. J. Mass Spectr.226, 223-237.
3. Santoni, V., Malloy, M., and Rabilloud, T. (2000) M e m b r a n e proteins andproteomics: un amour impossible? Electrophoresis21, 1054-1070.
4. Gygi, S., Corthals, G. L., Zhang, Y., Rochon, Y., and Aebersold, R. (2000) Evaluation of two-dimensional gel electrophoresis-based proteome analysis technology. Proc. Natl. Acad. Sci. USA97, 9390-9395.
5. Gorg, A., Obermaier, C., Boguth, G., et al. (2000) The current state of two-dimensional electrophoresis with immobilized p H gradients. Electrophoresis21,1037-1053.
6. Klein, C. Garcia-Rizo, C. Bisle, B., et al. (2005) T h e m e m b r a n e proteome ofHalobacterium salinarum. Proteomics5, 180-197.
7. Szponarski, W., Sommerer, N., Boyer, J. C., Rossignol M., and Gibrat, R. (2004)Large-scale characterization of integral proteins from Arabidopsisvacuolar membrane by two-dimensional liquid chromatography. Proteomics4, 397-406.
8. le Maire, M., Champeil, P., and Moller, J. V. (2000) Interaction of m e m b r a n eproteins and lipids with solubilizing detergents. Biochim. Biophys. Acta1508,86-111.
9. Seddon, A. M., Curnow, P., and Booth, P. J. (2004) M e m b r a n e proteins, lipidsand detergents: not just a soap opera. Biochim. Biophys. Acta1666, 105-117.
10. Zhang, W . and Chait, B. T. (2000) ProFound: an expert system for protein identification using mass spectrometric peptide mapping information. Anal. Chem.72,2482-2489; http://prowl.rockefeller.edu/profound_binAVebProFound.exe.
植物模式基因组测序和功能鉴定的研究成果以及快速增长的许多植物序列的数据 [1,2 ] ,使得用基质辅助激光解析飞行时间质谱(MALDI -TOF- MS ) 获得的肽质量指纹谱来鉴定蛋白质变得轻而易举。这种方法具有高灵敏度、高通量和低成本特点,但需要前期的蛋白质分离。由于膜镶嵌蛋白质在第一相的等电聚焦 (IEF ) 电泳中沉淀,目前最常用的以高分辨率解析从细胞中提取的蛋白质的二维凝胶电泳技术还不适于完全分离膜蛋白质组 ( 见第 11 章),相比之下,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳可有效分离膜镶嵌蛋白质。
下面要介绍的方法是以离子交换层析替代 2D-GE 电泳中 IEF,如果样品量充足,还可以辅以凝胶过滤色谱层析 [7] 。最终用 SDS-PAGE 电泳进一步分离膜镶嵌蛋白质。经过上述这些分离过程,许多膜镶嵌蛋白的胶内酶解和 MALDI-TOF/MS 分析获得了成功。
这个方法的目标之一是在一个单一的实验构架内,分离膜组分中不同类别的蛋白质,包括大部分的疏水、酸性和碱性蛋白。它们可通过染色胶和 MALDI-TOF/MS 蛋白质指纹谱进行蛋白质分析。本章节介绍的方法可能不能直接应用在其他材料上,但这些方法可以为读者在进行其他材料的实验过程中提供优化指导。
2. 材料
( 1 ) 分离缓冲液:5 mmol/L BTP-MES ( pH 7. 5 );0.2 mol/L 碘化钾, 1 mmol/L Na2EDTA,0.3 mol/L 甘露醇, 20% ( m/m) 甘油,5 mmol/L 二硫苏糖醇(DTT ) ,0.5% (V/V) 蛋白酶抑制剂混合物(Sigma 公司)和 15 mmol/L n-辛基-β-D-吡喃葡萄糖苷。
( 2 ) 增溶缓冲液:5 mmol/L BTP-MES ( pH 7.5 ),20% (m/m) 甘油和 0.5%(V/V) 蛋白酶抑制剂混合物(Sigma 公司)。
( 3 ) 洗脱缓冲液:3 mmol/L BTP-MES ( pH 7.5 ) ,1.5 mmol/L 十二烷基-β-D-麦芽糖苷(DM ) 和 20% 甘油(m/m) 。
( 4 ) Laemmli 样品缓冲液:4% ( m/V ) 十二烷基磺酸锂,20% ( m/m ) 甘油,10%(V/V) 2-巯基乙醇(2- ME) , 0.004% ( m/V ) 溴酚蓝,0.125 mol/L Tris-HCl,pH 6.8。
( 5 ) 胶段冲洗缓冲液:25 mrnol/L 碳酸氢铵,乙腈 50% ( V/V ) 。
( 6 ) 酶解缓冲液:15 mmol/L 碳酸氢铵。
( 7 ) 肽抽提缓冲液:乙腈 60% ( V/V ) ,0.15% ( V/V ) 三氟乙酸(TFA ) 。
4. 注释
( 1 ) 在分离膜蛋白时,还没有理想的方法彻底去除包覆亲水性蛋白和膜外周蛋白,使用亚临界胶团浓度的去垢剂打开膜蛋白微囊可能会不恰当地去除膜镶嵌蛋白质。判断膜分离过程的好坏,需要鉴定被去除掉的蛋白质。另外,如果无法去除膜外周蛋白质,那就跳过膜分离步骤,直接应用图 22-4 和 图 22-5 中表示的连续两步色谱层析(先是 GFC,然后是 AEC ) [7]。
( 2 ) 膜蛋白增溶是一步值得花时间仔细优化的实验步骤,首先,DM 已经被越来越广泛,而且也越来越成功地应用于增溶不同生物材料中具有功能活性的膜蛋白 [ 8,9] ,因此 ,它常常被推荐用做第一个测试实验。第二,DM/蛋白质的比例以及低速搅拌的增溶时间都需要进行优化实验。有时候在充满氩气和密封管子里的蛋白质混合物经过剧烈的涡旋振荡后可得到更高的增溶产率。
( 3 ) 应当通过预实验测试不同离子交换树脂对实验材料增溶蛋白质的分离效率,特别要比较层析柱结合蛋白质的容量和盐梯度洗脱结合在柱子上的蛋白质的能力。这里所用的膜材料,可被阳离子交换剂不可逆结合,所以最好使用阳离子交换剂(能洗脱出来 95% 的柱结合蛋白)。
( 4 ) 在 pH 7.0 条件下加样,约有 80% 的增溶蛋白质结合在 Mono Q HR 5/5 层析柱上(Amersham Biosciences 公司),增加样品加样缓冲液的 pH ( 最大可达 11) ,能提局蛋白质的柱结合率(最大可达 100%)。
( 5 ) 使用温和去垢剂增溶膜蛋白时,个别蛋白质可能会形成小的胶团,而超分子蛋白复合物可能会形成较大的胶团。若要估算胶团的大小,就需要取小样进行 GFC 色谱层析预实验,使用低样品进样量和宽分离范围的层析柱,如 Superose 6 10/30 ( Pharmacia/ Amersham Biosciences 公司), 这样可以让我们在以后的实验中选择更加合适的层析柱(具有较窄的分离范围、较强的分离能力以及较大的样品进样量)。
( 6 ) GFC 组分必须含有足够量的蛋白质(一般要 0.5 g 蛋白质),以保证第二级的 AEC 色谱层析和最后的 SDS-PAGE 电泳分离。
( 7 ) 防止胰蛋白酶的自身消化,对于有效消化蛋白质、在 MALDI-TOF 质谱上主要含胰蛋白酶消化肽以及减少其他肽段的信号来说,是非常重要的。为此我们必须做到以下几点:① 避免使用过量的胰蛋白酶,以上实验方法中介绍的胰蛋白酶使用量可以考虑为 7X2 mm、中等强度考马斯亮蓝染色的胶粒所需的最大量;② 尽量减少胰蛋白酶溶液的使用量,保证在 37°C 温浴之前的胶粒完全吸收胰蛋白酶溶液后,仅有一薄层胰蛋白酶溶液包裹着胶粒。注意之前提到的,在浓缩过程中,千万不要让含肽的溶液完全干燥。
( 8 ) 经过几十次激光轰击后,图谱质量常常变化很大,这似乎是膜蛋白肽段的特征,这意味着在介质表面的激光剥蚀和“ 易飞行”肽段的激光解析后,其他肽段能被进一步解析和离子化。因此,加和更多的质谱图谱(可多达 300 次激光轰击)将会带来更好的效果。
参考文献
1. G o d o v a c - Z i m m e r m a n n , J. and Brown, L. R. (2001) Perspectives for mass spectrometry and functional proteomics. Mass Spectrom. Rev.20, 1-57.
2. Rappsilber, J., Moniatte, M., Nielsen, M . L., Podtelejnikov, A.V., and Mann, M .(2003) Experiences and perspectives of M A L D I M S and M S / M S in proteomicresearch. Int. J. Mass Spectr.226, 223-237.
3. Santoni, V., Malloy, M., and Rabilloud, T. (2000) M e m b r a n e proteins andproteomics: un amour impossible? Electrophoresis21, 1054-1070.
4. Gygi, S., Corthals, G. L., Zhang, Y., Rochon, Y., and Aebersold, R. (2000) Evaluation of two-dimensional gel electrophoresis-based proteome analysis technology. Proc. Natl. Acad. Sci. USA97, 9390-9395.
5. Gorg, A., Obermaier, C., Boguth, G., et al. (2000) The current state of two-dimensional electrophoresis with immobilized p H gradients. Electrophoresis21,1037-1053.
6. Klein, C. Garcia-Rizo, C. Bisle, B., et al. (2005) T h e m e m b r a n e proteome ofHalobacterium salinarum. Proteomics5, 180-197.
7. Szponarski, W., Sommerer, N., Boyer, J. C., Rossignol M., and Gibrat, R. (2004)Large-scale characterization of integral proteins from Arabidopsisvacuolar membrane by two-dimensional liquid chromatography. Proteomics4, 397-406.
8. le Maire, M., Champeil, P., and Moller, J. V. (2000) Interaction of m e m b r a n eproteins and lipids with solubilizing detergents. Biochim. Biophys. Acta1508,86-111.
9. Seddon, A. M., Curnow, P., and Booth, P. J. (2004) M e m b r a n e proteins, lipidsand detergents: not just a soap opera. Biochim. Biophys. Acta1666, 105-117.
10. Zhang, W . and Chait, B. T. (2000) ProFound: an expert system for protein identification using mass spectrometric peptide mapping information. Anal. Chem.72,2482-2489; http://prowl.rockefeller.edu/profound_binAVebProFound.exe.