2D 凝胶的蛋白 Edman 测序
丁香园
2642
1. 前言
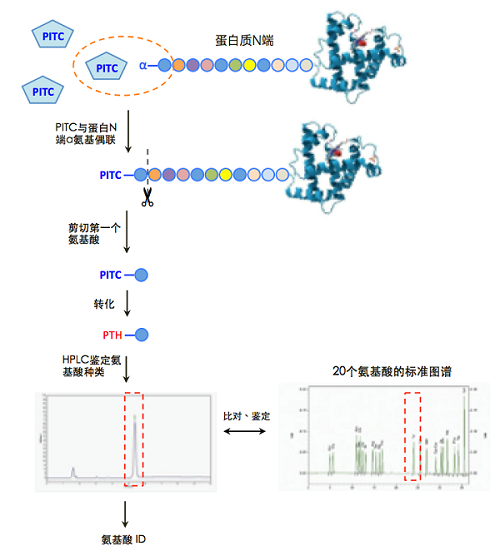
如能通过电转移或其他相关技术将蛋白样品从凝胶相有效转移到适合于气相测序 ( gas-phase sequencing) 的其他介质上时,则 2D 凝胶分离的蛋白可进行 Edman 测序 [1] 。首先,皮摩尔数量级的蛋白通过 2D-PAGE 分离 [2],然后经电转移从 2D-PAGE 凝胶上转移到 PVDF 膜上,再通过 Edman 测序法进行蛋白质的氨基酸测序。蛋白质 N 端顺序测定法—— Edman 降解是非常灵敏的测序方法(只需 1~5 μg 的蛋白质)。但是当出现缺口或模糊序列时,可以通过其他的方法来确认序列,而这往往需要更多的材料。
蛋白往往会进行翻译后修饰。N 端肽段封闭是较为常见的蛋白修饰之一。蛋白 N 端封闭既可以在体内也可在体外进行。但蛋白质抽提、2D-PAGE 和印迹可以防止这种 N 端封闭。使用非常纯的试剂,在抽提缓冲液、电泳和电转移缓冲液中加入自由基清除剂——巯基乙酸和进行预电泳以去除凝胶中的自由基清除剂都能有效阻止体外蛋白 N 端肽段的封闭 [3] 。然而,如果蛋白质的 N 端肽段在体内已封闭,则需用化学试剂、酶去封闭程序或者肽图谱程序来确定蛋白 N 端或内部的序列。
2. 材料
( 1 ) SDS 抽样缓冲液:0.06 mol/L Tris-HCl ( pH 6.8),2% SDS,10% 甘油,5% 巯基乙醇。
( 2 ) 分离胶用的丙烯酰胺(丙烯酰胺/甲叉双丙烯酰胺= 30:0.135):30.00 g 丙烯酰胺,0.135 g 甲叉双丙烯酰胺(BIS ) 。用 MQ ( Millipore 公司的 MilliQ 净水设备处理过的水)水定容至 100 ml,黑暗中保存(可使用棕色瓶子)。
( 3 ) 分离胶缓冲液(pH 8.8):称取 12.11 g Tris- HCl 配成 1 mol/L 的终浓度溶液,称取 0.27 g SDS 配成 0.27% 的终浓度溶液。溶于 80 ml MQ 水中,调至 pH 8.8,最后定容至 100 ml。
( 4 ) 浓缩胶用的丙烯酰胺(丙烯酰胺/甲叉双丙烯酰胺=29.2:0.8):29.2 g 丙烯酰胺,0.8 g BIS。用 MQ 水定容至 100 ml,黑暗中保存(可使用棕色瓶子)。
( 5 ) 浓缩胶缓冲液(pH 6.8):称取 3.03 g Tris-HCl,配成 0.25 mol/L 溶液,0.20 g SDS 配成 0.2% 溶液,溶于 80 ml MQ 水中,调 pH 为 6.8,最后定容至 100 ml。
( 6 ) SDS-PAGE 电泳缓冲液:9 g Tris-HCl,43.2 g 氨基乙酸,3 g SDS 溶于 3 L MQ 水中。
( 7 ) 溴酚蓝(BPB ) 溶液:称取 0.1 g BPB 溶于 100 ml 10% 的甘油中。
( 8 ) 印迹溶液 A:36.33 g Tris-HCl ( 终浓度为 0.3 mol/L ) ,200 ml 甲醇(终浓度为 20% ) ,0.20 g SDS ( 终浓度为 0.02%) 。用 MQ 水定容至 1000 ml,4°C 保存。
( 9 ) 印迹溶液 B:3.03 g Tris-HCl ( 终浓度为 25 mmol/L ) ,200 ml 甲醇(终浓度为 20% ) ,0.20 g SDS (终浓度为 0.02% ) ,用 MQ 水定容至 1000 ml,4°C 保存。
( 10 ) 印迹溶液 C:3.03 g Tris-HCl ( 终浓度为 25 mmol/L ) ,5.20 g β-氨基己酸(终浓度为 40 mmol/L ) ,200 ml 甲醇(终浓度为 20% ),0.20 g SDS ( 终浓度为 0.02% ) ,用 MQ 水定容至 1000 ml,4°C 保存。
( 11 ) 分离胶溶液 [ 一块胶的用量(18% )]:10 ml 分离胶用的丙烯酰胺,6.3 ml 分离胶缓冲液(pH 8.8),120 μl 10% APS,20 μl TEMED。
( 12 ) 浓缩胶溶液 [ 一块胶的用量(5% )]:1 ml 浓缩胶用的丙烯酰胺,3 ml 浓缩胶缓冲液(pH 6.8) ,2 ml MQ 水,30 μl 10% APS,20 μl TEMED。
4. 注释
( 1 ) 这些去封闭技术可以结合起来使用,也可以对固定在 PVDF 膜上的未知蛋白进行测序。结合在 PVDF 膜上的蛋白可直接用于测序。如果此时测序失败,可以取下 PVDF 膜,依次去除乙酰基、甲酰基和焦谷氨酸基,然后再测序。
( 2 ) 这种方法的优点是方便快捷,尽管与酰基氨基酸释放酶(AARE ) 消化相比,总的测序产率低。固定在膜上的蛋白先用胰蛋白酶消化后产生 N 端肽段。N 端肽段上的 N-乙酰化蛋白:N-乙酰化蛋白可用酰基氨基酸释放酶(AARE ) 进行去封闭。由于 AARE 解除短肽的酰基氨基酸,因此需要先用胰蛋白酶进行消化蛋白 [6]。
( 3 ) PVP-40 用来解离 PVDF 膜上的焦谷氨酸,而剩下的蛋白还结合在膜上。
参考文献
1. Eckerskorn, C., Mewes, W., Goretzki, H., and Lottspeich, F. (1988) A newsiliconized-gas fiber as support for protein-chemical analysis of electroblottedproteins. Eur. J. Biochem. 176, 5 09-512.
2 . OTarrell, P. F. (1975) High resolution two-dimensional electrophoresis ofproteins. / . Biol. Chem. 250, 4007-4021.
3. Hirano, H., Komatsu, S., Kajiwara, H., Takagi, Y., and Tsunasawa, S. (1993)Microsequence analysis of the N-terminally blocked proteins immobilized onpolyvinylidene difluoride membrane by Western blotting. Electrophoresi 1 4,839-846.
4. Laemmli, U. K. (1970) Cleavage of structural proteins during the assembly of thehead of bacteriophage T4. Nature 227, 680-685.
5. Cleveland, D. W., Fischer, S. G., Krischer, M. W., amd Laemmli, U. K. (1977)Peptide mapping by limited proteolysis in sodium dodecyl sulphate and analysisby gel electrophoresis, J. Biol. Chem. 252, 1102-1106.
6. Hirano, H., Komatsu, S., Nakamura, A., et al. (1991) Structural homology betweensemidwarfism-related proteins and glutelin seed protein in rice (Oryza sativaL.).Theor. Appl. Genet. 83, 153-158.
如能通过电转移或其他相关技术将蛋白样品从凝胶相有效转移到适合于气相测序 ( gas-phase sequencing) 的其他介质上时,则 2D 凝胶分离的蛋白可进行 Edman 测序 [1] 。首先,皮摩尔数量级的蛋白通过 2D-PAGE 分离 [2],然后经电转移从 2D-PAGE 凝胶上转移到 PVDF 膜上,再通过 Edman 测序法进行蛋白质的氨基酸测序。蛋白质 N 端顺序测定法—— Edman 降解是非常灵敏的测序方法(只需 1~5 μg 的蛋白质)。但是当出现缺口或模糊序列时,可以通过其他的方法来确认序列,而这往往需要更多的材料。
蛋白往往会进行翻译后修饰。N 端肽段封闭是较为常见的蛋白修饰之一。蛋白 N 端封闭既可以在体内也可在体外进行。但蛋白质抽提、2D-PAGE 和印迹可以防止这种 N 端封闭。使用非常纯的试剂,在抽提缓冲液、电泳和电转移缓冲液中加入自由基清除剂——巯基乙酸和进行预电泳以去除凝胶中的自由基清除剂都能有效阻止体外蛋白 N 端肽段的封闭 [3] 。然而,如果蛋白质的 N 端肽段在体内已封闭,则需用化学试剂、酶去封闭程序或者肽图谱程序来确定蛋白 N 端或内部的序列。
2. 材料
( 1 ) SDS 抽样缓冲液:0.06 mol/L Tris-HCl ( pH 6.8),2% SDS,10% 甘油,5% 巯基乙醇。
( 2 ) 分离胶用的丙烯酰胺(丙烯酰胺/甲叉双丙烯酰胺= 30:0.135):30.00 g 丙烯酰胺,0.135 g 甲叉双丙烯酰胺(BIS ) 。用 MQ ( Millipore 公司的 MilliQ 净水设备处理过的水)水定容至 100 ml,黑暗中保存(可使用棕色瓶子)。
( 3 ) 分离胶缓冲液(pH 8.8):称取 12.11 g Tris- HCl 配成 1 mol/L 的终浓度溶液,称取 0.27 g SDS 配成 0.27% 的终浓度溶液。溶于 80 ml MQ 水中,调至 pH 8.8,最后定容至 100 ml。
( 4 ) 浓缩胶用的丙烯酰胺(丙烯酰胺/甲叉双丙烯酰胺=29.2:0.8):29.2 g 丙烯酰胺,0.8 g BIS。用 MQ 水定容至 100 ml,黑暗中保存(可使用棕色瓶子)。
( 5 ) 浓缩胶缓冲液(pH 6.8):称取 3.03 g Tris-HCl,配成 0.25 mol/L 溶液,0.20 g SDS 配成 0.2% 溶液,溶于 80 ml MQ 水中,调 pH 为 6.8,最后定容至 100 ml。
( 6 ) SDS-PAGE 电泳缓冲液:9 g Tris-HCl,43.2 g 氨基乙酸,3 g SDS 溶于 3 L MQ 水中。
( 7 ) 溴酚蓝(BPB ) 溶液:称取 0.1 g BPB 溶于 100 ml 10% 的甘油中。
( 8 ) 印迹溶液 A:36.33 g Tris-HCl ( 终浓度为 0.3 mol/L ) ,200 ml 甲醇(终浓度为 20% ) ,0.20 g SDS ( 终浓度为 0.02%) 。用 MQ 水定容至 1000 ml,4°C 保存。
( 9 ) 印迹溶液 B:3.03 g Tris-HCl ( 终浓度为 25 mmol/L ) ,200 ml 甲醇(终浓度为 20% ) ,0.20 g SDS (终浓度为 0.02% ) ,用 MQ 水定容至 1000 ml,4°C 保存。
( 10 ) 印迹溶液 C:3.03 g Tris-HCl ( 终浓度为 25 mmol/L ) ,5.20 g β-氨基己酸(终浓度为 40 mmol/L ) ,200 ml 甲醇(终浓度为 20% ),0.20 g SDS ( 终浓度为 0.02% ) ,用 MQ 水定容至 1000 ml,4°C 保存。
( 11 ) 分离胶溶液 [ 一块胶的用量(18% )]:10 ml 分离胶用的丙烯酰胺,6.3 ml 分离胶缓冲液(pH 8.8),120 μl 10% APS,20 μl TEMED。
( 12 ) 浓缩胶溶液 [ 一块胶的用量(5% )]:1 ml 浓缩胶用的丙烯酰胺,3 ml 浓缩胶缓冲液(pH 6.8) ,2 ml MQ 水,30 μl 10% APS,20 μl TEMED。
4. 注释
( 1 ) 这些去封闭技术可以结合起来使用,也可以对固定在 PVDF 膜上的未知蛋白进行测序。结合在 PVDF 膜上的蛋白可直接用于测序。如果此时测序失败,可以取下 PVDF 膜,依次去除乙酰基、甲酰基和焦谷氨酸基,然后再测序。
( 2 ) 这种方法的优点是方便快捷,尽管与酰基氨基酸释放酶(AARE ) 消化相比,总的测序产率低。固定在膜上的蛋白先用胰蛋白酶消化后产生 N 端肽段。N 端肽段上的 N-乙酰化蛋白:N-乙酰化蛋白可用酰基氨基酸释放酶(AARE ) 进行去封闭。由于 AARE 解除短肽的酰基氨基酸,因此需要先用胰蛋白酶进行消化蛋白 [6]。
( 3 ) PVP-40 用来解离 PVDF 膜上的焦谷氨酸,而剩下的蛋白还结合在膜上。
参考文献
1. Eckerskorn, C., Mewes, W., Goretzki, H., and Lottspeich, F. (1988) A newsiliconized-gas fiber as support for protein-chemical analysis of electroblottedproteins. Eur. J. Biochem. 176, 5 09-512.
2 . OTarrell, P. F. (1975) High resolution two-dimensional electrophoresis ofproteins. / . Biol. Chem. 250, 4007-4021.
3. Hirano, H., Komatsu, S., Kajiwara, H., Takagi, Y., and Tsunasawa, S. (1993)Microsequence analysis of the N-terminally blocked proteins immobilized onpolyvinylidene difluoride membrane by Western blotting. Electrophoresi 1 4,839-846.
4. Laemmli, U. K. (1970) Cleavage of structural proteins during the assembly of thehead of bacteriophage T4. Nature 227, 680-685.
5. Cleveland, D. W., Fischer, S. G., Krischer, M. W., amd Laemmli, U. K. (1977)Peptide mapping by limited proteolysis in sodium dodecyl sulphate and analysisby gel electrophoresis, J. Biol. Chem. 252, 1102-1106.
6. Hirano, H., Komatsu, S., Nakamura, A., et al. (1991) Structural homology betweensemidwarfism-related proteins and glutelin seed protein in rice (Oryza sativaL.).Theor. Appl. Genet. 83, 153-158.