植物质膜蛋白的提取和溶解
丁香园
7606
1. 前言
植物质膜(PM ) 调控着细胞与环境之间的信息和物质交流。这种界面的位置赋予 PM 蛋白在细胞活动中的关键作用,如信号转导、代谢、离子运输和内吞,以及对病原体的反应和细胞壁融合,这些都是具体的植物职能。细胞膜物理化学性质的不同是它们分离的基础。质膜可以根据三大程序纯化。
( 1 ) PM 与其他膜之间大小和密度的不同是用于分离的一个特点。该步骤需要对微粒部分进行连续或非连续的密度梯度离心 [1] 。
( 2 ) 自由流电泳程序利用细胞膜的电荷来分离细胞膜 [2] 。PM 比其他膜带更多的负电荷并且因此可以有效地跟其他细胞膜分离。但这种做法需要一个特殊的自由流电泳仪装置。
( 3 ) 用两相分离法分离 PM 部分依赖于膜囊泡之间不同起源的表面特性。这一技术潜在的原则是众多的水溶高分子质量的聚合物超过一定浓度不相互混合,而是形成分离相,每个分离相包含 85% 以上的水。这种含聚合物的分离相很适合做生物分析材料。根据不同的表面特性加入的膜在水性聚合物相之间被分离这项技术最初由 Laesson 等 [ 3 ]描述,现在由于它实现了 PM 蛋白的高产和没有其他内膜污染,已被广泛使用在对植物群落的科学研究,此外,它是一个简单的方案,不需要特定的设备。
膜蛋白可分为两组:那些跨越脂质双层的蛋白被定义为内在或整合蛋白质,其他的为膜联蛋白。联合过程是由翻译后的修饰,如通过嫁接一个不饱和脂肪酸或蛋白质互作播定糖脂来介导的。这暗示了蛋白质与 PM 关联的动力学的发生。在富含质膜的部分,无论是外在的功能与 PM 相关的蛋白质或胞质内的污染物 [4] ,很大比例(60%~80% ) 的蛋白质是可溶的。因此,由于整合蛋白质在 PM 部分的比例低,当直接溶解 PM 部分时,即使用如十二烷基硫酸钠(SDS) 这种最高效率的去垢剂,可能在复性整合蛋白质方面效率也是低的。
以使用去污剂 [ 5 ] 、有机溶剂 [ 5~7 ] 或碱性处理膜 [ 5,8,9 ] 为基础的方法被用来分离镶嵌蛋白。其中,作为一种容易的且有效率的方法,碱性提取已得到了广泛普及,在不影响组分完整的情况下,有选择性地从膜上分离外在的蛋白质 [ 10 ] 。在本章中,描述了一个基于用碱性-尿素处理 PM 的方案,此方案能够复性疏水性非常强的蛋白质,如水通道蛋白 [ 11~13 ] 。
越来越多的数据显示,膜蛋白的功能和亚细胞定位是受翻译后修饰调控的。双向凝胶电泳构建了一个通用的能够分离修饰后蛋白质的方法。因此,由于等电点 pI 或是表观分子质量的不同,糖基化、酰基化或脱酰基化后的蛋白质点会成列出现 [ 14,15 ];磷酸化和 α-乙酰化分别把蛋白质的 pI 转向酸性 pH 和碱性 pH,但不改变表观分子质量。更为普遍的是,任何带电残基的共价修饰,都会修改蛋白质的净电荷,反过来使蛋白的 pI 发生变化。由于它们的高疏水性,造成了双向凝胶电泳分析整合蛋白质的局限性,需要使用特殊的溶解步骤 [18 ] ( 见第 12 章),并且表达丰度低。本章描述了从模式植物拟南芥的根和叶悬浮细胞中纯化 PM 的方案,得到能用于蛋白质组学分析的可溶性 PM 蛋白。水通道蛋白是含有 6 个跨膜 α-螺旋 [ 19~22] ,26~35 kDa 的疏水性质膜镶嵌蛋白(PIP ) ,被用来作为评估相关的提取及溶解方案的对照蛋白质。
2. 材料
2.1 生物材料
( 1 ) 拟南芥属(Heynh.) 植物(生态型为 Wassilewskija 或 Columbia ) , 培养条件如 Santoni 等 [13] 所述:营养液栽培。
( 2 ) 拟南芥属(Heynh. ),生态型为哥伦比亚,24°C,连续光照的悬浮培养细胞,参照 Gerbeau 等 [23] 。
2.2 设备
( 1 ) 超纯水(双蒸,去离子),用于所有试剂的配制。
( 2 ) 作为合适用途(细胞培养,超纯电泳),试剂级别应该是最高级别的。
( 3 ) 华林式搅拌器:机械破坏植物材料(叶片和根)来生成悬浮细胞(见 11. 3.1节 1) 。
( 4 ) 细胞破碎器:破坏拟南芥悬浮细胞(见 11.3.1 节 1)。Constant System,Warwick,UK )。
( 5 ) 固定化 pH 梯度(IPG;线性和非线性 pH 梯度 3~10,长 18 cm;AmershamPharmacia Biotech)。
( 6 ) IPGphor 设备:分离电泳聚焦蛋白质(Amersham Pharmacia Biotech) 。
( 7 ) Protean I I:用于十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE ) (BioRad)。
2.3 试剂
1. 产品和液体贮存液
( 1 ) 葡聚糖 T-500 和聚乙二醇(PEG ) 3350 分别购自 Amersham 和 Union Carbide。根据分子质量分别配制 20% 和 40% 的葡聚糖 T-500 和 PEG 3350 的贮存液(见注释 1)。
( 2 ) 0.2 mol/L 的二水 EDTA 钠盐(的 EDTA - Na2) 贮存液的配置:500 ml 的水 ( 终体积)溶解 37.2 g 的 EDTA -Na2。在粉末中用 Trizma 碱(Sigma) 调整 pH 为 8。贮存在室温下数月。
( 3 ) 0.2 mol/L EGTA 贮存液的配置:在 500 ml 的水(终体积)中溶解 38.1 g EGTA。用 Trizma 碱调整 pH 为 8。贮存在室温下数月。
( 4 ) leupeptin ( Sigma,编号为 L2884 ) 配制成 10 mmol/L 贮存液(5 mg,1.05 mol/L 水),存放于 -20°C 半年。
( 5 ) 0.5 mol/L NaF 贮存液:在 500 ml 的水中溶解 10.5 g 氟化钠。贮存在室温,最多保存一个月。
( 6 ) 0.2 mol/L pH 7.8 的磷酸盐缓冲液贮存液:在 50 ml 的水中溶解 1.4 g KH2PO4。在 500 ml 的水中溶解 17.4 g K2HPO4。混合两种贮存液,配制成 550 ml 的 0.2 mol/L 磷酸盐缓冲液,pH 7.8。贮存在 -20°C,可放置数月。
2. 缓冲液
( 1 ) 悬浮细胞的洗涤缓冲液(WBSC ):20 mmol/L 氯化钾,5 mmol/L EDTA。这个缓冲液是从 10 倍贮存液制成的 200 mmol/L KCl ( 在 1 L 中溶解 14.9 g) 与 50 mmol/L 的 EDTA ( 在 1L 中溶解 18.6 g) 混合在一起。-20°C 贮存数月。
( 2 ) 均匀的介质:匀质化介质的最低要求,是存在一个渗透势从而减少细胞器的肿胀和破裂,缓冲液的 pH 7~8,从而减少水解酶活性和抵消液泡的低 pH,并且控制自由二价金属离子。β-甘油,原钒酸钠,邻菲罗啉构成磷蛋白磷酸酶抑制剂的混合物,该抑制剂被证明有利于维持细胞活性的特异性,如在 PM 水平的水分转运的活性。氟化钠是一种磷脂酶抑制剂,加上 EGTA 和 EDTA,减少磷脂活性。Leupeptin 是一种蛋白酶抑制剂。抗坏血酸是一种抗氧化剂,二硫苏糖醇是一种巯基保护剂。聚乙烯吡咯烷酮(PVP ) 被加入以吸附酚类化合物。组成见表 11-1。
( 3 ) 微粒缓冲液:微粒体颗粒悬浮在一种与分相方案兼容的缓冲液中。成分如表 11-2所示。
( 4 ) 分离相:用于 PM 分离的 2 个聚体分别是葡聚糖 T-500 和聚乙二醇 3350,6.4 (m/m) 。两相系统也含有 5 mmol/L 磷酸钾(pH 7.8 ) 起缓冲作用,蔗糖用来提供渗透势,KCl 用以修改相位。用于从拟南芥叶和根悬浮细胞分离质膜。相分离系统的成分组成见表 11-3 ( 见注释 1 和注释 2)。
( 5 ) PM 洗涤缓冲液:通过在洗涤缓冲液中稀释分离相来清洁 PM;组成成分见表 11-4。
( 6 ) 镶嵌的 PM 蛋白用尿素-氢氧化钠处理提取:提取镶嵌蛋白质的缓冲液的组成见表 11-5 和表 11-6。尿素是用来作为离液剂。





4. 注释
( 1 ) 制备葡聚糖 T-500:由于右旋糖酐 T-500 易潮,必须检测提取浓度。首先,220 g 葡聚糖 T-500 溶解在 780 g 水中轻微摇动。完成溶解大约需要 2 h。然后 5 g 的溶液溶解在 25 ml 水中并且在 589 nm 测量旋光度,作为具体的旋光度是 + 199 ° /ml/g/dm,终浓度(%,m/m) 由以下公式得出:旋光度 X 25 X 100/199X5 。

为了确保用于一系列的实验的葡聚糖 T-500 的一致性,一次要多制备一些,尤其是如果没有用旋光计校正匍聚糖的含水量,这点变得十分必要。在这里,贮存液是由含水量为 5% 的葡聚糖 T-500 制备而成。不同批次的葡聚糖 T-500 的分子质量也有差异。意味着,不同批次的葡聚糖 T-500,对层相分离系统的能力需要进行重新评估,并对层相分离系统组成进行必要的调整。
( 2 ) 层相分离系统的贮存液分装后贮存于 -20°C。两相体系的构成以重量为基准,其体积取决于系统要承载多少膜材料。如表 11-3 显示了如何建立一个 27 g 的样本系统,并且该系统将与其后的 9 g 微粒体混合,从而最后形成 36 g 层相分离体系。准备后,两相系统可以贮存在 -20°C。
( 3 ) 蛋白质浓度用改进的 Bradford 步骤 [29] 估算并且以牛血清白蛋白作为蛋白质的标准。

( 4 ) 两相体系的应用:本章描述的两相分离步骤适应于拟南芥的叶片、根系和悬浮细胞。应用于任何其他植物材料时需要修改相分离的组分。可通过改变聚合物浓度和该相体系的盐组成来实现最优分离条件。选用绿色组织体为实验材料可以直接用肉眼观察细胞内膜在层相分离系统中的分离情况,从而迅速判断最佳聚合物和盐浓度。作为一个起点,大规模的实验应该根据本章描述的步骤来开展。如果上层相 up3 和 up4 (图 11-1) 是绿的,在不改变 KCl 浓度的前提下,需要准备一系列的小层相分离系统(在表 11-3 介绍的 10% 的相系统 )。应在较低的相中选择分离叶绿素的最低聚合物浓度。另一方面,如果上层相 up3 和 up4 ( 图 11-1) 是白色,并且只有非常低的蛋白质产量,那么应该选用较低浓度的聚合物进行层相分离。据 Widell 和 Larsson 选择合适酶标准进行检测,来评估 PM 部分的纯度(见注释 5) 。
( 5 ) PM 纯度标准:由于蛋白质组学不是静态的,因此借此来评估质膜的纯度是件困难的事。此外,由于质膜具有一定的可塑性,即使在同一组织的不同发育阶段或外界环境变化或由一种细胞器转运到另一种细胞器中的蛋白质组图谱都有可能发生变化。尽管如此,特异酶标准可以粗略评估其他膜的存在情况。本章不重点阐述此评估方法,具体参见 Widell 和 Larsson。Mg-ATPase 对钒酸盐、寡霉素和硝酸钾的敏感度被广泛检测质膜、线粒体和液泡膜的存在。IDPase 的活性用于检测高尔基体膜的存在,采用本章介绍的方案提取的质膜表现出对钒酸盐、寡霉素和硝酸钾不同的敏感度,分别占总 ATPase 活性的 83%、低于 1% 和 13%。IDPase 的活性占总 ATPase 活性的 4% [ 4,13,33] 。
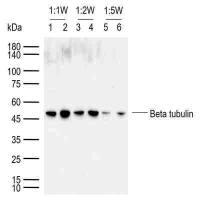
( 6 ) 采用不同提取方法得到的质膜疏水性蛋白通过蛋白质组学分析在质量和数量上均有差异,这表明不同的提取方法适合不同特定的质膜疏水性蛋白 [5] 。特别是与去垢剂 ( Triton X-114,单独使用 Triton X-100 和 Triton X-100 与机溶剂配合使用)相比,碱处理使 PM 疏水蛋白更好地复性 [5] 。与碱性处理比较显示,碳酸处理 PMM (30% ) 比尿素氢氧化钠处理 (20% ) 得到了较高的蛋白质产量,但免疫检测显示后者的处理可得到更丰富的疏水性水通道蛋白(图 11-2 ) 。
( 7 ) 由于 SDS 高的溶解效率,SDS- PAGE 电泳仍然是最好的分离疏水性蛋白质的方法之一。质谱分析可以鉴定 SDS-PAGE 条带中的蛋白质,即使同一条带中包含几种蛋白质也能成功鉴定。因此,用 ESI-MS/MS 分析用尿素氢氧化钠处理的 PM 的 28 kDa 的条带时显示存在至少 5 个水通道蛋白亚基(图 11-3)。这一结果揭示了质谱的强大,能够把高度同源的蛋白质区分开来。因而,SDSTAGE 电泳结合质谱分析构成一种有效的策略,可用于建立一个疏水性蛋白质库。但是,SDS-PAGE 并不能确定鉴定到那些经过翻译后修饰,分子质量不变但等电点 pI 改变的蛋白质。二维凝胶电泳技术可以帮助补充这个不足 [13],并且提供了在二维凝胶上良好的恢复疏水性蛋白的手段(图 11-4)。
( 8 ) 溶解缓冲液的对比分析显示提取步骤不同的去垢剂效率不同。特别是,芳香核心的去垢剂(例如 C89 ) 显示去油脂效果不佳,但可有效打破蛋白质聚合「5,27] 。相比之下,线性去垢剂(例如 ASB14 ) 可有效地去油脂,但不能打破蛋白质的聚合在一个优化的步骤中,疏水颗粒的蛋白质溶解于尿素、硫脲和去垢剂同时存在的溶液里,可以是 β-dodecylmatoside 或 ASB14 ( 表 11-8 和图 11-5)。第 12 章对疏水蛋白质溶解步骤进行标准评价。
参考文献
1. Hodges, T. K. and Mills, D. (1986) Isolation of the plasma membrane. MethodsEnzymol.118,41-54.
2. Bardy, N., Carrasco, A., Galaud, J. P., Pont-Lezica, R., and Canut, H. (1998) Freeflow electrophoresis for fractionation of Arabidopsis thalianamembranes. Electrophoresis19, 1145-1153.
3. Larsson, C., Widell, S., and Kjellbom, P. (1987) Preparation of high-purity plasmamembranes. Methods Enzymol. 148, 558-568.
4. Santoni, V., Rouquie, D., Doumas, P., et al. (1998) Use of aproteome strategy fortagging proteins present at the plasma membrane. Plant J. 16, 633-641.
5. Santoni, V., Kieffer, S., Masson, F., Desclaux, D., and Rabilloud, T. (2000) Membrane proteomics: use of additive main effects with multiplicative interaction modelto classify plasma membrane proteins according to their solubility and electrophoretic properties. Electrophoresis 21, 3329-3344.
6. Ferro, M., Salvi, D., Riviere-Rolland, H., et al. (2002) Integral membrane proteinsof the chloroplast envelope: Identification and subcellular localization of new transporters. Proc. Natl. Acad. Sci. USA 99, 11,487-11,492.
7. Marmagne, A., Rouet, M. A., Ferro, M., et al. (2004) Identification of new intrinsicproteins in Arabidopsis plasma membrane proteome. Mol. Cell. Proteomics 3,675-691.
8 . Santoni, V., Rabilloud T., Doumas P., et al. (1999) Towards the recovery ofhydrophobic proteins on two-dimensional electrophoresis gels. Electrophoresis 20,705—711.
9. Millar, A. H. and Heazlewood, J. L. (2003) Genomic and proteomic analysis ofmitochondrial carrier proteins in Arabidopsis. Plant Physiol.131,443-453.
1 0 . Fujiki, Y., Hubbard, A. L., Fowler, S., and Lazarow, P. B. (1982) Isolation ofintracellular membranes by means of sodium carbonate treatment: application toendoplasmic reticulum. J. Cell Biol. 9 3, 97-102.
11. Hasler, L., Walz, T., Tittmann, P., Gross, H., Kistler, J., and Engel, A. (1998)Purified lens major intrinsic protein (MIP) forms highly ordered tetragonal two-dimensional arrays by reconstitution. J. Mol. Biol. 279, 855-864.
1 2 . Fotiadis, D., Jenos, P., Mini, T., et al. (2001) Structural characterization of twoaquaporins isolated from native spinach leaf plasma membranes. J. Biol. Chem.276, 1707-1714.
13. Santoni, V., Vinh, J., Pflieger, D., Sommerer, N., and Maurel, C. (2003) Aproteomic study reveals novel insights into the diversity of aquaporin forms expressed in the plasma membrane of plant roots. Biochem. J.373, 289-296.
1 4. Sarioglu, H., Lottspeich, F., Walk, T., Jung, G., and Eckerskorn, C. (2000)Deamidation as a widespread phenomenon in two-dimensional polyacrylamidegel electrophoresis of human blood plasma proteins. Electrophoresis 21, 2209-2218.
15. Packer, N. H., Pawlak, A., Kett, W. C., Gooley, A. A., Redmond, J. W., and Williams, K. L. (1997) Proteome analysis of glycoforms: a review of strategies for themicrocharacterisation of glycoproteins separated by two-dimensional polyacrylamide gel electrophoresis. Electrophoresis1 8 , 452-460.
16. Towbin, H., Ozbey, 0 ., and Zingel, O. (2001) An immunoblotting method for high-resolution isoelectric focusing of protein isoforms on immobilized pH gradients.Electrophoresis 22, 1887-1893.
17. Kimura, Y., Takaoka, M., Tanaka, S., et al. (2000) Na-acetylation and proteolyticactivity of the yeast 20S proteasome. J. Biol. Chem. 2 75, 4635-4639.
18 . Santoni, V., Molloy, M., and Rabilloud, T. (2000) Membrane proteins andproteomics: un amour impossible? Electrophoresis 2 1, 1054-1070.
19. Fu, D., Libson, A., Miercke, L. J. W., et al. (2000) Structure of a glycerol-con-ducting channel and the basis for its selectivity. Science 290 , 481-486.
20. Sui, H., Han, B. G., Lee, J. K., Walian, P., and Jap, B. K. (2001) Structural basis ofwater-specific transport through the AQP1 water channel. Nature 414, 872-878.
21. Johanson, U., Karlsson, M., Johansson, I., et al. (2001) The complete set of genesencoding major intrinsic proteins in Arabidopsis provides a framework for a newnomenclature for major intrinsic proteins in plants. Plant Physiol.126, 1-12.
22. Quigley, F., Rosenberg, J. M., Shachar-Hill, Y., and Bohnert, H. J. (2002) Fromgenome to function: the Arabidopsis aquaporins. Genome Biol. 3, 1-17.
23. Gerbeau, P., Amodeo, G., Henzler, T., Santoni, V., Ripoche, P., and Maurel, C.(2002) The water permeability of Arabidopsis plasma membrane is regulated bydivalent cations and pH. Plant J.3 0 , 71-81.
24. Whitman, C. E. and Travis, R. L. (1985) Phospholipid composition of a plasmamembrane-enriched fraction from developing soybean roots. Plant Physiol. 7 9 ,494498 .
25. Laemmli, U. K. (1970) Cleavage of structural proteins during the assembly of thehead of bacteriophage T4. Nature 222, 680-865.
26. Chevallet, M., Santoni, V., Poinas, A., et al. (1998) New zwitterionic detergentsimprove the analysis of membrane proteins by two-dimensional electrophoresis.Electrophoresis 19,1901-1909.
27. Luche, S., Santoni, V., and Rabilloud, T. (2003) Evaluation of non-ionic andzwitterionic detergents as membrane protein solubilizers in two-dimensionalelectrophoresis. Proteomics3,249-253.
28. Adessi, C., Miege, C., Albrieux, C., and Rabilloud, T. (1997) Two-dimensionalelectrophoresis of membrane proteins: a current challenge for immobilized pHgradients. Electrophoresis18,127-135.
29. Stoscheck, C. M. (1990) Quantitation of proteins. Methods Enzymol. 182, 50-68.
30. Widell, S. and Larsson, C. (1990) A critical evaluation of markers used in plasmamembrane purification, in The Plant Plasma Membrane-Structure, Function andMolecular Biology (Larsson, C. and Moller, I. M., eds.), Springer-Verlag, Berlin,pp.16-4 3.
31. Masson, F. and Rossignol, M. (1995) Basic plasticity of protein expression intobacco plasma membrane. Plant J. 8, 77-85.
32. Santoni, V., Vansuyt, G., and Rossignol, M. (1990) Differential auxin sensitivityof proton translocation by plasma membrane H+-ATPase from tobacco leaves.Plant Sci. 68, 33-38.
33. Santoni, V., P, D., Rouquie D, Mansion M, Rabilloud T, and Rossignol, M. (1999)Large scale characterization of plant plasma membrane proteins. Biochimie 8 1,655-661.
植物质膜(PM ) 调控着细胞与环境之间的信息和物质交流。这种界面的位置赋予 PM 蛋白在细胞活动中的关键作用,如信号转导、代谢、离子运输和内吞,以及对病原体的反应和细胞壁融合,这些都是具体的植物职能。细胞膜物理化学性质的不同是它们分离的基础。质膜可以根据三大程序纯化。
( 1 ) PM 与其他膜之间大小和密度的不同是用于分离的一个特点。该步骤需要对微粒部分进行连续或非连续的密度梯度离心 [1] 。
( 2 ) 自由流电泳程序利用细胞膜的电荷来分离细胞膜 [2] 。PM 比其他膜带更多的负电荷并且因此可以有效地跟其他细胞膜分离。但这种做法需要一个特殊的自由流电泳仪装置。
( 3 ) 用两相分离法分离 PM 部分依赖于膜囊泡之间不同起源的表面特性。这一技术潜在的原则是众多的水溶高分子质量的聚合物超过一定浓度不相互混合,而是形成分离相,每个分离相包含 85% 以上的水。这种含聚合物的分离相很适合做生物分析材料。根据不同的表面特性加入的膜在水性聚合物相之间被分离这项技术最初由 Laesson 等 [ 3 ]描述,现在由于它实现了 PM 蛋白的高产和没有其他内膜污染,已被广泛使用在对植物群落的科学研究,此外,它是一个简单的方案,不需要特定的设备。
膜蛋白可分为两组:那些跨越脂质双层的蛋白被定义为内在或整合蛋白质,其他的为膜联蛋白。联合过程是由翻译后的修饰,如通过嫁接一个不饱和脂肪酸或蛋白质互作播定糖脂来介导的。这暗示了蛋白质与 PM 关联的动力学的发生。在富含质膜的部分,无论是外在的功能与 PM 相关的蛋白质或胞质内的污染物 [4] ,很大比例(60%~80% ) 的蛋白质是可溶的。因此,由于整合蛋白质在 PM 部分的比例低,当直接溶解 PM 部分时,即使用如十二烷基硫酸钠(SDS) 这种最高效率的去垢剂,可能在复性整合蛋白质方面效率也是低的。
以使用去污剂 [ 5 ] 、有机溶剂 [ 5~7 ] 或碱性处理膜 [ 5,8,9 ] 为基础的方法被用来分离镶嵌蛋白。其中,作为一种容易的且有效率的方法,碱性提取已得到了广泛普及,在不影响组分完整的情况下,有选择性地从膜上分离外在的蛋白质 [ 10 ] 。在本章中,描述了一个基于用碱性-尿素处理 PM 的方案,此方案能够复性疏水性非常强的蛋白质,如水通道蛋白 [ 11~13 ] 。
越来越多的数据显示,膜蛋白的功能和亚细胞定位是受翻译后修饰调控的。双向凝胶电泳构建了一个通用的能够分离修饰后蛋白质的方法。因此,由于等电点 pI 或是表观分子质量的不同,糖基化、酰基化或脱酰基化后的蛋白质点会成列出现 [ 14,15 ];磷酸化和 α-乙酰化分别把蛋白质的 pI 转向酸性 pH 和碱性 pH,但不改变表观分子质量。更为普遍的是,任何带电残基的共价修饰,都会修改蛋白质的净电荷,反过来使蛋白的 pI 发生变化。由于它们的高疏水性,造成了双向凝胶电泳分析整合蛋白质的局限性,需要使用特殊的溶解步骤 [18 ] ( 见第 12 章),并且表达丰度低。本章描述了从模式植物拟南芥的根和叶悬浮细胞中纯化 PM 的方案,得到能用于蛋白质组学分析的可溶性 PM 蛋白。水通道蛋白是含有 6 个跨膜 α-螺旋 [ 19~22] ,26~35 kDa 的疏水性质膜镶嵌蛋白(PIP ) ,被用来作为评估相关的提取及溶解方案的对照蛋白质。
2. 材料
2.1 生物材料
( 1 ) 拟南芥属(Heynh.) 植物(生态型为 Wassilewskija 或 Columbia ) , 培养条件如 Santoni 等 [13] 所述:营养液栽培。
( 2 ) 拟南芥属(Heynh. ),生态型为哥伦比亚,24°C,连续光照的悬浮培养细胞,参照 Gerbeau 等 [23] 。
2.2 设备
( 1 ) 超纯水(双蒸,去离子),用于所有试剂的配制。
( 2 ) 作为合适用途(细胞培养,超纯电泳),试剂级别应该是最高级别的。
( 3 ) 华林式搅拌器:机械破坏植物材料(叶片和根)来生成悬浮细胞(见 11. 3.1节 1) 。
( 4 ) 细胞破碎器:破坏拟南芥悬浮细胞(见 11.3.1 节 1)。Constant System,Warwick,UK )。
( 5 ) 固定化 pH 梯度(IPG;线性和非线性 pH 梯度 3~10,长 18 cm;AmershamPharmacia Biotech)。
( 6 ) IPGphor 设备:分离电泳聚焦蛋白质(Amersham Pharmacia Biotech) 。
( 7 ) Protean I I:用于十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE ) (BioRad)。
2.3 试剂
1. 产品和液体贮存液
( 1 ) 葡聚糖 T-500 和聚乙二醇(PEG ) 3350 分别购自 Amersham 和 Union Carbide。根据分子质量分别配制 20% 和 40% 的葡聚糖 T-500 和 PEG 3350 的贮存液(见注释 1)。
( 2 ) 0.2 mol/L 的二水 EDTA 钠盐(的 EDTA - Na2) 贮存液的配置:500 ml 的水 ( 终体积)溶解 37.2 g 的 EDTA -Na2。在粉末中用 Trizma 碱(Sigma) 调整 pH 为 8。贮存在室温下数月。
( 3 ) 0.2 mol/L EGTA 贮存液的配置:在 500 ml 的水(终体积)中溶解 38.1 g EGTA。用 Trizma 碱调整 pH 为 8。贮存在室温下数月。
( 4 ) leupeptin ( Sigma,编号为 L2884 ) 配制成 10 mmol/L 贮存液(5 mg,1.05 mol/L 水),存放于 -20°C 半年。
( 5 ) 0.5 mol/L NaF 贮存液:在 500 ml 的水中溶解 10.5 g 氟化钠。贮存在室温,最多保存一个月。
( 6 ) 0.2 mol/L pH 7.8 的磷酸盐缓冲液贮存液:在 50 ml 的水中溶解 1.4 g KH2PO4。在 500 ml 的水中溶解 17.4 g K2HPO4。混合两种贮存液,配制成 550 ml 的 0.2 mol/L 磷酸盐缓冲液,pH 7.8。贮存在 -20°C,可放置数月。
2. 缓冲液
( 1 ) 悬浮细胞的洗涤缓冲液(WBSC ):20 mmol/L 氯化钾,5 mmol/L EDTA。这个缓冲液是从 10 倍贮存液制成的 200 mmol/L KCl ( 在 1 L 中溶解 14.9 g) 与 50 mmol/L 的 EDTA ( 在 1L 中溶解 18.6 g) 混合在一起。-20°C 贮存数月。
( 2 ) 均匀的介质:匀质化介质的最低要求,是存在一个渗透势从而减少细胞器的肿胀和破裂,缓冲液的 pH 7~8,从而减少水解酶活性和抵消液泡的低 pH,并且控制自由二价金属离子。β-甘油,原钒酸钠,邻菲罗啉构成磷蛋白磷酸酶抑制剂的混合物,该抑制剂被证明有利于维持细胞活性的特异性,如在 PM 水平的水分转运的活性。氟化钠是一种磷脂酶抑制剂,加上 EGTA 和 EDTA,减少磷脂活性。Leupeptin 是一种蛋白酶抑制剂。抗坏血酸是一种抗氧化剂,二硫苏糖醇是一种巯基保护剂。聚乙烯吡咯烷酮(PVP ) 被加入以吸附酚类化合物。组成见表 11-1。
( 3 ) 微粒缓冲液:微粒体颗粒悬浮在一种与分相方案兼容的缓冲液中。成分如表 11-2所示。
( 4 ) 分离相:用于 PM 分离的 2 个聚体分别是葡聚糖 T-500 和聚乙二醇 3350,6.4 (m/m) 。两相系统也含有 5 mmol/L 磷酸钾(pH 7.8 ) 起缓冲作用,蔗糖用来提供渗透势,KCl 用以修改相位。用于从拟南芥叶和根悬浮细胞分离质膜。相分离系统的成分组成见表 11-3 ( 见注释 1 和注释 2)。
( 5 ) PM 洗涤缓冲液:通过在洗涤缓冲液中稀释分离相来清洁 PM;组成成分见表 11-4。
( 6 ) 镶嵌的 PM 蛋白用尿素-氢氧化钠处理提取:提取镶嵌蛋白质的缓冲液的组成见表 11-5 和表 11-6。尿素是用来作为离液剂。





4. 注释
( 1 ) 制备葡聚糖 T-500:由于右旋糖酐 T-500 易潮,必须检测提取浓度。首先,220 g 葡聚糖 T-500 溶解在 780 g 水中轻微摇动。完成溶解大约需要 2 h。然后 5 g 的溶液溶解在 25 ml 水中并且在 589 nm 测量旋光度,作为具体的旋光度是 + 199 ° /ml/g/dm,终浓度(%,m/m) 由以下公式得出:旋光度 X 25 X 100/199X5 。

为了确保用于一系列的实验的葡聚糖 T-500 的一致性,一次要多制备一些,尤其是如果没有用旋光计校正匍聚糖的含水量,这点变得十分必要。在这里,贮存液是由含水量为 5% 的葡聚糖 T-500 制备而成。不同批次的葡聚糖 T-500 的分子质量也有差异。意味着,不同批次的葡聚糖 T-500,对层相分离系统的能力需要进行重新评估,并对层相分离系统组成进行必要的调整。
( 2 ) 层相分离系统的贮存液分装后贮存于 -20°C。两相体系的构成以重量为基准,其体积取决于系统要承载多少膜材料。如表 11-3 显示了如何建立一个 27 g 的样本系统,并且该系统将与其后的 9 g 微粒体混合,从而最后形成 36 g 层相分离体系。准备后,两相系统可以贮存在 -20°C。
( 3 ) 蛋白质浓度用改进的 Bradford 步骤 [29] 估算并且以牛血清白蛋白作为蛋白质的标准。

( 4 ) 两相体系的应用:本章描述的两相分离步骤适应于拟南芥的叶片、根系和悬浮细胞。应用于任何其他植物材料时需要修改相分离的组分。可通过改变聚合物浓度和该相体系的盐组成来实现最优分离条件。选用绿色组织体为实验材料可以直接用肉眼观察细胞内膜在层相分离系统中的分离情况,从而迅速判断最佳聚合物和盐浓度。作为一个起点,大规模的实验应该根据本章描述的步骤来开展。如果上层相 up3 和 up4 (图 11-1) 是绿的,在不改变 KCl 浓度的前提下,需要准备一系列的小层相分离系统(在表 11-3 介绍的 10% 的相系统 )。应在较低的相中选择分离叶绿素的最低聚合物浓度。另一方面,如果上层相 up3 和 up4 ( 图 11-1) 是白色,并且只有非常低的蛋白质产量,那么应该选用较低浓度的聚合物进行层相分离。据 Widell 和 Larsson 选择合适酶标准进行检测,来评估 PM 部分的纯度(见注释 5) 。
( 5 ) PM 纯度标准:由于蛋白质组学不是静态的,因此借此来评估质膜的纯度是件困难的事。此外,由于质膜具有一定的可塑性,即使在同一组织的不同发育阶段或外界环境变化或由一种细胞器转运到另一种细胞器中的蛋白质组图谱都有可能发生变化。尽管如此,特异酶标准可以粗略评估其他膜的存在情况。本章不重点阐述此评估方法,具体参见 Widell 和 Larsson。Mg-ATPase 对钒酸盐、寡霉素和硝酸钾的敏感度被广泛检测质膜、线粒体和液泡膜的存在。IDPase 的活性用于检测高尔基体膜的存在,采用本章介绍的方案提取的质膜表现出对钒酸盐、寡霉素和硝酸钾不同的敏感度,分别占总 ATPase 活性的 83%、低于 1% 和 13%。IDPase 的活性占总 ATPase 活性的 4% [ 4,13,33] 。
( 6 ) 采用不同提取方法得到的质膜疏水性蛋白通过蛋白质组学分析在质量和数量上均有差异,这表明不同的提取方法适合不同特定的质膜疏水性蛋白 [5] 。特别是与去垢剂 ( Triton X-114,单独使用 Triton X-100 和 Triton X-100 与机溶剂配合使用)相比,碱处理使 PM 疏水蛋白更好地复性 [5] 。与碱性处理比较显示,碳酸处理 PMM (30% ) 比尿素氢氧化钠处理 (20% ) 得到了较高的蛋白质产量,但免疫检测显示后者的处理可得到更丰富的疏水性水通道蛋白(图 11-2 ) 。
( 7 ) 由于 SDS 高的溶解效率,SDS- PAGE 电泳仍然是最好的分离疏水性蛋白质的方法之一。质谱分析可以鉴定 SDS-PAGE 条带中的蛋白质,即使同一条带中包含几种蛋白质也能成功鉴定。因此,用 ESI-MS/MS 分析用尿素氢氧化钠处理的 PM 的 28 kDa 的条带时显示存在至少 5 个水通道蛋白亚基(图 11-3)。这一结果揭示了质谱的强大,能够把高度同源的蛋白质区分开来。因而,SDSTAGE 电泳结合质谱分析构成一种有效的策略,可用于建立一个疏水性蛋白质库。但是,SDS-PAGE 并不能确定鉴定到那些经过翻译后修饰,分子质量不变但等电点 pI 改变的蛋白质。二维凝胶电泳技术可以帮助补充这个不足 [13],并且提供了在二维凝胶上良好的恢复疏水性蛋白的手段(图 11-4)。
( 8 ) 溶解缓冲液的对比分析显示提取步骤不同的去垢剂效率不同。特别是,芳香核心的去垢剂(例如 C89 ) 显示去油脂效果不佳,但可有效打破蛋白质聚合「5,27] 。相比之下,线性去垢剂(例如 ASB14 ) 可有效地去油脂,但不能打破蛋白质的聚合在一个优化的步骤中,疏水颗粒的蛋白质溶解于尿素、硫脲和去垢剂同时存在的溶液里,可以是 β-dodecylmatoside 或 ASB14 ( 表 11-8 和图 11-5)。第 12 章对疏水蛋白质溶解步骤进行标准评价。
参考文献
1. Hodges, T. K. and Mills, D. (1986) Isolation of the plasma membrane. MethodsEnzymol.118,41-54.
2. Bardy, N., Carrasco, A., Galaud, J. P., Pont-Lezica, R., and Canut, H. (1998) Freeflow electrophoresis for fractionation of Arabidopsis thalianamembranes. Electrophoresis19, 1145-1153.
3. Larsson, C., Widell, S., and Kjellbom, P. (1987) Preparation of high-purity plasmamembranes. Methods Enzymol. 148, 558-568.
4. Santoni, V., Rouquie, D., Doumas, P., et al. (1998) Use of aproteome strategy fortagging proteins present at the plasma membrane. Plant J. 16, 633-641.
5. Santoni, V., Kieffer, S., Masson, F., Desclaux, D., and Rabilloud, T. (2000) Membrane proteomics: use of additive main effects with multiplicative interaction modelto classify plasma membrane proteins according to their solubility and electrophoretic properties. Electrophoresis 21, 3329-3344.
6. Ferro, M., Salvi, D., Riviere-Rolland, H., et al. (2002) Integral membrane proteinsof the chloroplast envelope: Identification and subcellular localization of new transporters. Proc. Natl. Acad. Sci. USA 99, 11,487-11,492.
7. Marmagne, A., Rouet, M. A., Ferro, M., et al. (2004) Identification of new intrinsicproteins in Arabidopsis plasma membrane proteome. Mol. Cell. Proteomics 3,675-691.
8 . Santoni, V., Rabilloud T., Doumas P., et al. (1999) Towards the recovery ofhydrophobic proteins on two-dimensional electrophoresis gels. Electrophoresis 20,705—711.
9. Millar, A. H. and Heazlewood, J. L. (2003) Genomic and proteomic analysis ofmitochondrial carrier proteins in Arabidopsis. Plant Physiol.131,443-453.
1 0 . Fujiki, Y., Hubbard, A. L., Fowler, S., and Lazarow, P. B. (1982) Isolation ofintracellular membranes by means of sodium carbonate treatment: application toendoplasmic reticulum. J. Cell Biol. 9 3, 97-102.
11. Hasler, L., Walz, T., Tittmann, P., Gross, H., Kistler, J., and Engel, A. (1998)Purified lens major intrinsic protein (MIP) forms highly ordered tetragonal two-dimensional arrays by reconstitution. J. Mol. Biol. 279, 855-864.
1 2 . Fotiadis, D., Jenos, P., Mini, T., et al. (2001) Structural characterization of twoaquaporins isolated from native spinach leaf plasma membranes. J. Biol. Chem.276, 1707-1714.
13. Santoni, V., Vinh, J., Pflieger, D., Sommerer, N., and Maurel, C. (2003) Aproteomic study reveals novel insights into the diversity of aquaporin forms expressed in the plasma membrane of plant roots. Biochem. J.373, 289-296.
1 4. Sarioglu, H., Lottspeich, F., Walk, T., Jung, G., and Eckerskorn, C. (2000)Deamidation as a widespread phenomenon in two-dimensional polyacrylamidegel electrophoresis of human blood plasma proteins. Electrophoresis 21, 2209-2218.
15. Packer, N. H., Pawlak, A., Kett, W. C., Gooley, A. A., Redmond, J. W., and Williams, K. L. (1997) Proteome analysis of glycoforms: a review of strategies for themicrocharacterisation of glycoproteins separated by two-dimensional polyacrylamide gel electrophoresis. Electrophoresis1 8 , 452-460.
16. Towbin, H., Ozbey, 0 ., and Zingel, O. (2001) An immunoblotting method for high-resolution isoelectric focusing of protein isoforms on immobilized pH gradients.Electrophoresis 22, 1887-1893.
17. Kimura, Y., Takaoka, M., Tanaka, S., et al. (2000) Na-acetylation and proteolyticactivity of the yeast 20S proteasome. J. Biol. Chem. 2 75, 4635-4639.
18 . Santoni, V., Molloy, M., and Rabilloud, T. (2000) Membrane proteins andproteomics: un amour impossible? Electrophoresis 2 1, 1054-1070.
19. Fu, D., Libson, A., Miercke, L. J. W., et al. (2000) Structure of a glycerol-con-ducting channel and the basis for its selectivity. Science 290 , 481-486.
20. Sui, H., Han, B. G., Lee, J. K., Walian, P., and Jap, B. K. (2001) Structural basis ofwater-specific transport through the AQP1 water channel. Nature 414, 872-878.
21. Johanson, U., Karlsson, M., Johansson, I., et al. (2001) The complete set of genesencoding major intrinsic proteins in Arabidopsis provides a framework for a newnomenclature for major intrinsic proteins in plants. Plant Physiol.126, 1-12.
22. Quigley, F., Rosenberg, J. M., Shachar-Hill, Y., and Bohnert, H. J. (2002) Fromgenome to function: the Arabidopsis aquaporins. Genome Biol. 3, 1-17.
23. Gerbeau, P., Amodeo, G., Henzler, T., Santoni, V., Ripoche, P., and Maurel, C.(2002) The water permeability of Arabidopsis plasma membrane is regulated bydivalent cations and pH. Plant J.3 0 , 71-81.
24. Whitman, C. E. and Travis, R. L. (1985) Phospholipid composition of a plasmamembrane-enriched fraction from developing soybean roots. Plant Physiol. 7 9 ,494498 .
25. Laemmli, U. K. (1970) Cleavage of structural proteins during the assembly of thehead of bacteriophage T4. Nature 222, 680-865.
26. Chevallet, M., Santoni, V., Poinas, A., et al. (1998) New zwitterionic detergentsimprove the analysis of membrane proteins by two-dimensional electrophoresis.Electrophoresis 19,1901-1909.
27. Luche, S., Santoni, V., and Rabilloud, T. (2003) Evaluation of non-ionic andzwitterionic detergents as membrane protein solubilizers in two-dimensionalelectrophoresis. Proteomics3,249-253.
28. Adessi, C., Miege, C., Albrieux, C., and Rabilloud, T. (1997) Two-dimensionalelectrophoresis of membrane proteins: a current challenge for immobilized pHgradients. Electrophoresis18,127-135.
29. Stoscheck, C. M. (1990) Quantitation of proteins. Methods Enzymol. 182, 50-68.
30. Widell, S. and Larsson, C. (1990) A critical evaluation of markers used in plasmamembrane purification, in The Plant Plasma Membrane-Structure, Function andMolecular Biology (Larsson, C. and Moller, I. M., eds.), Springer-Verlag, Berlin,pp.16-4 3.
31. Masson, F. and Rossignol, M. (1995) Basic plasticity of protein expression intobacco plasma membrane. Plant J. 8, 77-85.
32. Santoni, V., Vansuyt, G., and Rossignol, M. (1990) Differential auxin sensitivityof proton translocation by plasma membrane H+-ATPase from tobacco leaves.Plant Sci. 68, 33-38.
33. Santoni, V., P, D., Rouquie D, Mansion M, Rabilloud T, and Rossignol, M. (1999)Large scale characterization of plant plasma membrane proteins. Biochimie 8 1,655-661.