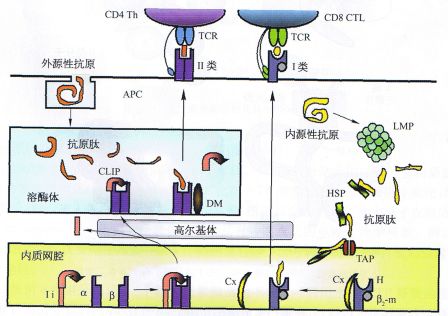
蛋白质降解的泛素―蛋白酶体途径
互联网
泛素(ubiquitin,Ub)是76个氨基残基组成的小分子多肽,可以以共价结合的方式与蛋白质的赖氨酸相连。蛋白质一旦接有泛素,称为发生泛素化(uhiquitylation)。泛素化在ATP的参与下被三种酶依序催化,形成蛋白质与一条泛素聚合链相结合的复合结构,进入蛋白酶体,然后降解为肽段。
此为生物大分子在胞质中降解的泛素―蛋白酶体途径(ubiquitimproteosomepathway)。泛素化是一个具有普遍意义的免疫生物学现象。例如第一章提到NF-~B激活中抑制成分I-~cB的降解,以及免疫调节一章中将提到细胞因子信号转导抑制蛋白(SOCS)对底物的作用,皆涉及这一泛素―蛋白酶体途径。
蛋白质泛素化系统由3个组分构成,一个称为泛素激活酶n,它可利用水解ATP释放的能量以其胱氨酸残基(Cys)的巯基与泛素C端的甘氨酸残基(Gly)形成高能硫酯键。然后连接在殿上的泛素被转移到另一个泛素结合酶E2上,同时,被选中的靶蛋白与第三个组分即靶蛋白泛素连接酶E3结合。
E2然后将与其连接的泛素转移到靶蛋白上,并与靶蛋白赖氨酸残基(Lys)―NH2基团形成异肽键(isopeptidebond),E2被释放。选择什么样的蛋白质进行泛素化主要取决于E2和E3。
内源性抗原肽依据该途径实施降解,具体涉及两个作用环路。其一是泛素与底物结合,然后在分解酶(deconjugatmg enzyme)DUB的作用下重新游离,已如上述;二是结合有调节复合物的28S免疫蛋白酶体,对带有泛素聚合链的内源性抗原肽实施降解,然后再回复到19S调节复合物及20S蛋白酶体,构成第二个环路。
两者共同作用的结果是,泛素化的内源性抗原进入免疫蛋白酶体的孔道后,在蛋白水解酶的作用下降解成为5~15个氨基酸残基的短肽。