体外哺乳动物细胞 TK 基因突变试验方法及导则
TK 基因突变试验的检测终点是 TK 基因的突变。TK 基因突变属于常染色体基因突变。TK 基因的产物胸苷激酶在体内催化从脱氧胸苷(TdR)生成胸苷酸(TMP)的反应。在正常情况下,此反应并非生命所必需,原因是体内的 TMP 主要来自于脱氧尿嘧啶核苷酸(dUMP),即由胸苷酸合成酶催化的 dUMP 甲基化反应生成 TMP。但如在细胞培养物中加入胸苷类似物(如三氟胸苷,即 trifluorothymidine,TFT),则 TFT 在胸苷激酶的催化下可生成三氟胸苷酸,进而掺入 DNA,造成致死性突变,故细胞不能存活。若 TK 基因发生突变,导致胸苷激酶缺陷,则 TFT 不能磷酸化,亦不能掺 DNA,故突变细胞在含有 TFT 的培养基中能够生长,即表现出对 TFT 的抗性。根据突变集落形成数可计算突变频率,从而推断受试物的致突变性。在 TK 基因突变试验结果观察中可发现两类明显不同集落,即大/小集落(L5178Y 细胞)或正常生长/缓慢生长集落(TK6 细胞),有研究表明,大集落/正常生长集落主要由点突变或较小范围的缺失等引起,而小集落/缓慢生长集落主要由较大范围的染色体畸变,或由涉及调控细胞增殖的基因缺失引起。
北京汇智泰康医药技术有限公司针对小鼠淋巴瘤细胞 TK 基因突变试验开发染 TK 基因突变试剂盒,本试剂盒针对小鼠淋巴瘤细胞 L5178Y 开展 TK 基因突变试验,试剂盒省去了阳性底物成分、筛选培养基准备、诱导 S9 制备,可以直接使用,大大缩短了实验周期;试剂盒各成分均经过严格的质量检测,无杂菌污染,诱导 S9 活性均符合小鼠淋巴瘤细胞 TK 基因突变试验要求,实验结果准确、可靠、重现性高。染色体畸变试验试剂盒应用广泛,可进行食品、化学品、农药、消毒剂、食品添加剂、药物残留、化妆品、容器与包装材料等多个方面的遗传毒理学检测。
TK 基因突变试验导则
1 范围
本标准规定了体外哺乳类胸苷激旃(thymidine kinase TK)基因突变试验的基本试验方法与技术要求。
本标准适用于评价受试物的致突变作用术语和定义 TK 基因哺乳类动物的胸苷激基因。
2 术语和定义
2.1 TK 基因
人类的 TK 基因定位于 17 号染色体长臂远端;小鼠的则定位于号染色体。
2.2 突变频率
在某种细胞系中,某一特定基因突变型的细胞(集落)占细胞(集落)总数的比例(单位通常为 10-6)。
3 原理
TK 基因突变试验的检测终点是 TK 基因的突变。TK 基因突变属于常染色体基因突变。
TK 基因的产物胸苷激酶在体内催化从脱氧胸苷(TdR)生成胸苷酸(TMP)的反应。在正常情况下,此反应并非生命所必需,原因是体内的 TMP 主要来自于脱氧尿嘧啶核苷酸(dUMP),即由胸苷酸合成酶催化的 dUMP 甲基化反应生成 TMP。但如在细胞培养物中加入胸苷类似物(如三氟胸苷,即 trifluorothymidine,TFT),则 TFT 在胸苷激酶的催化下可生成三氟胸苷酸,进而掺入 DNA,造成致死性突变,故细胞不能存活。若 TK 基因发生突变,导致胸苷激酶缺陷,则 TFT 不能磷酸化,亦不能掺 DNA,故突变细胞在含有 TFT 的培养基中能够生长,即表现出对 TFT 的抗性。根据突变集落形成数可计算突变频率,从而推断受试物的致突变性。在 TK 基因突变试验结果观察中可发现两类明显不同集落,即大/小集落(L5178Y 细胞)或正常生长/缓慢生长集落(TK6 细胞),有研究表明,大集落/正常生长集落主要由点突变或较小范围的缺失等引起,而小集落/缓慢生长集落主要由较大范围的染色体畸变,或由涉及调控细胞增殖的基因缺失引起。
4 仪器和设备
培养箱、恒温水浴、二氧化碳培养箱、压力蒸汽消毒器、、低温冰箱(-80 ℃) 或液氮生物容器、普通冰箱、天平(精密度 0.1 g 和 0.0001 g)、生物安全柜、倒置显微镜、离心机、无菌细胞培养瓶,玻璃器皿等。
5 培养基
5.1 完全培养基
RPMI1640 培养液,加入 10% 马血清(培养瓶培养)或 20% 马血清(96 孔板培养)及适量抗菌素(青霉素、链霉素的最终浓度分别为 100 IU/mL 及 100 μg/mL。
5.2 THMG 和 TMG 选择培养基 THMG 培养基
THMG 培养基:3 μg/mL 胸腺嘧啶核苷( thymidine,T)+5 μg/mL 次黄嘌呤( hypoxanthine,H)+0.1 μg/mL 氨甲喋昤( methotrexate,M)+7.5 μg/mL 甘氨酸( glycine,G)。
THG 培养基:3 μg/mL 胸腺嘧啶核苷(T)+5 μg/mL 次黄嘌昤(H)+7.5 μg/mL 甘氨酸(G)。
以上浓度为各试剂在培养基中的终浓度。实际试验中,常按照表 1 的方法把 THMG 和 THG 配成 100 倍浓度,在试剂盒中即为 100 倍浓度。
6 试验方法
6.1 细胞和培养条件
TK+/- 型的 L5178Y-3.7.2C 小鼠淋巴瘤细胞或 TK6 人类淋巴母细胞。
两种细胞均在 5% 二氧化碳、37 ℃、饱和湿度条件下作常规悬浮培养。
为避免在培养和传代期间自发突变的细胞对试验结果的影响,在正式试验前,应清除自发突变的 TK-/-基因型细胞。方法是:
a)对于 L5178Y 细胞,使用 THMG 培养基处理 24 h,以 800r/min~1000 r/minm 的速度离心 4~6 min、洗涤后在不含氨甲喋呤的 THG 培养基中培养 2d;
b)对于 TK6 细胞,使用 CHAT 培养基处理 48 h,以 800r/min~1000 r/min 的速度离心 4~6 min、洗涤后在不含氨基喋呤的 CHT 培养基中继续培养 3d。
6.2 受试物
6.2.1 受试物的配制
固体受试物应溶于或悬浮于适当的溶剂或赋形剂中,在处理细胞前适当稀释。液体受试物可直接加至试验系统和或于染毒前稀释。应该使用新鲜制备的受试物,除非稳定性资料证实可以贮存。
6.2.2 受试物剂量设定
至少应设置 3 个~4 个可供分析的浓度。对于有细胞毒性的受试物,应根据细胞毒性预试验结果在 RS 或 RSG 为 20%~80% 范围内设 3 个~4 个剂量(浓度)水平,同时应该考虑受试物对溶解度、pH 和摩尔渗透压浓度的影响。方法是:取生长良好的细胞,调整密度为 5×105/mL,按 1% 体积加入不同浓度受试物,37 ℃ 震摇处理 3 h(L5178Y 细胞)或 4 h(TK6 细胞),细胞经离心洗涤后,作 2d(L5178Y 细胞)或 3d(TK6 细胞)表达培养,每天计数细胞密度并计算相对悬浮生长(RSG)。或取上述处理后细胞悬液,作梯度稀释至 8 个细胞/mL,接种 96 孔板(每孔加 0.2 mL,即平均 1,6 个细胞/孔),每个剂量种 1 块~2 块平板,,37 ℃,5% 二氧化碳,饱和湿度条件下培养 12d,计数每块平板有集落生长的孔数,计算相对存活率(RS)。
对于细胞毒性极低的受试物,最高浓度应设为 5 mg/ mL、5uL/mL 或 0.01mol/L.。对于相对不溶解的物质,其最高浓度的设置应达到不影响细胞培养的最大可加入浓度。
6.2.3 对照
一般情况下,每一项试验中,在代谢活化系统存在和不存在的条件下均应设阳性和阴性(溶媒)对照瓶组。
当使用代谢活化系统时,阳性对照物应使用要求代谢活化、并能引起典型突变集落的物质,可以使用 3-甲基胆(3- methyleholanthrene)、环磷酰胺( cyclophosphamide,CP)等。在没有代谢活化系统时阳性对照物可使用甲基磺酸甲酯( methyl methane sulfonate,MMS)、丝裂莓素 C( mitomycin C,MMC)、甲基磺酸乙酯( ethylmethane sulfonate,EMS)等使用其他适宜的阳性对照物。
溶媒应是非致突变物,不与受试物发生化学反应,不影响细胞存活和 S9 活性。溶媒首选蒸馏水,如使用非水溶媒(可选择二甲基亚砜、丙酮、乙醇等),则需增设溶媒对照。
6.3 处理
取生长良好的细胞,调整密度为 5×105/mL,按 1% 体积加入受试物(需代谢活化的情况下,同时加终浓度为 10% 的 S9 混合物),37 ℃ 振摇处理 3 h(L5178Y 细胞)或 4 h(TK6 细胞),以 800~100 r/min 的速度离心 4 min-6 min,弃上清液,用 PBS 或不含血清的培养基洗涤细胞 2 遍,重新悬浮细胞于含 10% 马血清的 RPMI1640 培养液中,并调整细胞密度为 2×105/mL。
6.4 PE0(0d 的平板接种效率)测定
取适量细胞悬液,作梯度稀释至 8 个细胞/mL,接种 96 孔板(每孔加 0.2 mL,即平均 1.6 个细胞/孔),每个剂量种 1 块~2 块平板,37 ℃,5% 二氧化碳,饱和湿度条件下培养 12d。计数每块平板有集落生长的孔数。
6.5 表达
取 6.3 所得细胞悬液,作 2d(1L5178Y 细胞)或 3d(TK6 细胞)表达培养,每天计数细胞密度并保持密度在 106/mL 以下,计算相对悬浮生长(RSG)。
6.6 PE2(L5178Y 细胞)或 PE3 (TK6 细胞)测定
表达培养结束后,取适量细胞悬液,按 6.4 方法测定 PE2/ PE3。
6.7 突变频率(MF)测定
6.7.1 L5178Y 细胞
L5178Y 细胞表达培养 2d 后,取适量细胞悬液,调整细胞密度为 1×104/mL,加人 TFT(终浓度为 3 ug/mL.),混匀,接种 96 孔板(每孔加 0.2 mL,即平均 2000 个细胞/孔),每个剂量作 2 块~4 块板,37 ℃,5% 二氧化碳,饱和湿度条件下培养 12d,计数有突变集落生长的孔数。突变集落按大集落 Large Colony,LC:直径 ≥ 1/4 孔径,密度低)和小集落(small colony,SC:直径<1/4 孔径,密度高)分別计数。极小集落可再继续培养 3d 后计数.
7 大鼠肝微粒体酶的诱导和 S9 的制备
7.1 诱导
最广泛应用的大鼠肝微粒体酶的诱导剂是多氯联苯(PCB 混合物),选择健康雄性大鼠体重 200 g 左右,一次腹腔注射诱导剂,剂量为 500 mg/kg 体重。诱导剂溶于玉米油中,浓度为 200 mg/mL。苯巴比妥钠和 β-萘黄酮结合也可做为诱导剂。
7.2 S9 制备
动物诱导后第五日断头处死。处死前 12 h 停止饮食,但可自由饮水。首先,用 75% 酒精消毒动物皮毛,剖开腹部。在无菌条件下,取出肝脏,去除肝脏的结缔组织,用冰浴的 0.15 mol/L 氯化钾溶液淋洗肝脏,放入盛有 0.15 mol/L 氯化钾溶液的烧杯里。按每克肝脏加入 0.15mol/L 氯化钾溶液 3 mL。用电动匀浆器制成肝匀浆,再在低温高速离心机上,在 4 ℃ 条件下,以 9000 g 离心 10 min,取其上清液(S9)分装于塑料管中。每管装 2 mL ~3 mL。储存于液氮生物容器中或 -80 ℃ 冰箱中备用。
上述全部操作均在冰水浴中和无菌条件下进行。制备肝 S9 所用一切手术器械、器皿等,均经灭菌消毒。S9 制备后,其活力需经诊断性诱变剂进行鉴定。大鼠肝微粒体肝 S9 制备过程时间较久,也可以直接联系北京汇智泰康购买现有肝微粒体,肝 S9,NADPH 再生系统,UGT 孵育系统等产品。
8 数据处理和结果评价
8.1 数据处理
8.1.1 平板效率(PE0、PE2)
其中,EW 为无集落孔数,TW 为总的孔数,1.6 为每孔接种细胞数。
8.1.2 相对存活率(RS):

8.1.3 相对悬浮生长(RSG)每日细胞增长率(DGG):

8.1.4 相对悬浮生长(RSG)

8.1.5 相对总生长(relative total growth,RTG)
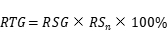
其中,RSn 第 2 天(L5178Y 细胞)的相对存活率。
8.1.6 突变频率(MF)
其中:
EW——96 孔板无集落孔数;
TW——96 孔板总的孔数;
N——每孔接种细胞数(此处 N = 2000),
PE2——第 2 天 L5178Y 细胞的平板效率。
此外,对于 L5178Y 细胞,可分別计算大集落突变率(L-MF)、小集落突变频率(S-MF)和总突变频率(T-MF)。对于 TK6 细胞,可分别计算正常集落突变频率(N-MF),缓慢生长集落突变频率 S-MF)和总突变频率(T-MF)。
8.1.7 小集落突变百分率

8.2 结果评价
8.2.1 试验成立条件
试验所用 L5178Y 细胞的自发突変频率应在 50×10-6~200×10-6 之间;TK6 细胞的自发突变频率应在 1.5×10-6~5.5×10-6 之间,同时自发突变频率应在本实验室历史记录范围内。阴性/溶媒对照的 PE0 在 60%~140% 之间,PE2/ PE3 的值在 70%~130% 之间。阳性对照的 T-MF 与阴性/溶媒对照有显著差异,或是阴性/溶媒对照 3 倍以上。
8.2.2 受试物阳性和阴性结果的判定
与阴性照组相比较,在所有染毒条件下,一个或多个剂量水平上基因突变频率差值超过 126.0×10-6(总评价因子,GEF)。
试验样品所诱发的基因突变频率出现浓度依赖性的增加。
结果同时满足上述标准,判定为阳性结果;否则,判定为阴性结果
9 试验的解释
TK 基因突变试验具有较高的敏感性,可检出包括点突变、大的缺失、重组、异倍体和其他较大范围基因组改变在内的多种遗传改变,长时间处理还可检出某些断裂剂、纺锤体毒物和多倍体诱导剂等。但体外试验不能完全模拟哺乳动物体内代谢条件,因此,本试验结果不能直接外推到哺乳动物。阳性结果表明受试样品在该试验条件下可引起所用哺乳类细胞基因突变;阴性结果表明在该试验条件下受试样品不引起所用哺乳类细胞基因突变。评价时应综合考虑生物学意义和统计学意义。
汇智泰康 TK 基因突变试剂盒优势
便捷—— 本试剂盒省去了诱导 S9 制备,阳性底物、筛选培养基的配制和浓度条件摸索的时间,可以直接使用,大大缩短了实验周期。
准确——本试剂盒各成分均经过严格的质量检测,无杂菌污染,诱导 S9 活性均符合 L5178Y 细胞基因突变试验要求,实验结果准确、可靠、重现性高。
稳定—— 本试剂盒稳定性强、易于运输和保存。
常见问题及原因分析
1、细胞自发突变范围不在 50×10-6~200×10-6 之间:需要再做一次细胞自发突变清除,直至自发突变在 50×10-6~200×10-6
2、工作量较大:可以将有代谢活化和无代谢活化试验分开进行,减小工作量,确保试验准确性。
TK 基因突变试剂盒使用说明书
【试验原理】
TK 基因突变试验的检测终点是 TK 基因的突变。在细胞培养物中加入三氟胸苷(TFT),则 TFT 在胸苷激酶的催化下生成三氟胸苷酸,进而参入 DNA,造成致死性突变,细胞不能存活;若 TK 基因发生突变,导致细胞胸苷激酶(TK)缺陷,则 TFT 不能磷酸化,亦不能掺入 DNA,突变细胞表现出对 TFT 抗性,在 TFT 存在条件下仍能生长。在有或无代谢活化的条件下,将细胞培养物暴露于受试物适当时间,经适当的培养时间,计数集落,计算突变频率,从而推断受试物致突变性。
【产品说明】
汇智泰康 TK 基因突变试剂盒提供进行体外哺乳动物细胞 TK 基因突变试验所需的主要试剂和细胞,可用于评价受试物的致突变作用。其中所用细胞和试剂均符合国标要求,且在国标的基础上引入了 MTT 染色法,使的结果观察更为直观,为实验结果的可靠性提供了支持。
产品组分 | 规格 | 数量 | 使用说明 | 保存条件 |
细胞(L5178Y) | 1 mL | 1 | / | -70 ℃ |
THMG(100×) | 0.5 mL | 1 | 使用前混匀 | |
THG(100×) | 0.5 mL | 1 | 使用前混匀 | |
S9 复合物 | 5.0 mL | 1 | 冰浴融化并混匀 | |
环磷酰胺(CP) | 0.5 mL | 1 | 800 μg/mL,使用前混匀 | |
三氟胸苷(1000) | 2 mL | 1 | 3 mg/mL,使用前混匀 | |
磷酸盐缓冲液 | 60 mL | 1 | 使用前混匀 | 室温 |
甲基磺酸甲酯(MMS) | 0.5 mL | 1 | 1.5 mg/mL,使用前混匀 | |
染色剂 MTT | 70 mL | 2 | 1 mg/mL,使用时 10 μL/孔加入 96 孔板中 |
【产品使用说明】
1、细胞复苏
从-70 冰箱取出细胞,于 37 ℃ 水浴融化,1000 rpm 离心 5 min,弃上清,用含 10% 马血清、0.2 mg/mL 丙酮酸钠的 RPMI 1640 培养液(RPMI-10)中重悬细胞;1000 rpm 再次离心 5 min,弃上清,用 RPMI-10 重悬后接种于细胞瓶中培养。
2、自发突变细胞清除
取对数生长期细胞悬液,于含 1% 的 THMG(100×)的完全培养基中培养 24 h,1000 r/min 离心 5 min,洗涤后于含 1% 的 THG(100×)完全培养基中继续培养 2 d。
注:为确保试验的可行性,试验中所用细胞的自发突变率应在 50×10-6~200×10-6 之间,清除自发突变的细胞传代使用不得超过 1 个月,每次试验前需将细胞清除自发突变。
3、染毒处理
取生长良好的细胞,调整细胞密度为 5×105 个/mL(细胞数可根据实验室情况做调整),在加或不加代谢活化系统的条件下,按 1% 的体积加入不同浓度的受试物,37 ℃,70 rpm/min 染毒处理 3 h,每个试验组平行处理两份培养物。
(1)S9 混合液及染毒用细胞液配制
S9 混合液配制(30 mL) | ||
S9 复合物 | 4.8 mL | 现配现用。使用过程中,于冰浴条件下保存。 试验结束后,剩余溶液应丢弃,不可重复使用。 |
磷酸盐缓冲液 | 25.2 mL | |
活化条件下染毒用细胞悬液配制(19.8 mL/体系,共 12 个体系) | ||
细胞悬液 | 120 mL | 混合均匀后,19.8 mL/管分装于 50 mL 无菌离心管或细胞培养瓶中,备用。 |
RPMI-10 培养液 | 93.6 mL | |
S9 混合液 | 24 mL | |
非活化条件下染毒用细胞悬液配制(19.8 mL/体系,共 12 个体系) | ||
细胞悬液 | 120 mL | 混合均匀后,19.8 mL/管分装于 50 mL 无菌离心管或细胞培养瓶中,备用。 |
RPMI-10 培养液 | 93.6 mL | |
磷酸盐缓冲液 | 24 mL |
注:在试验过程中,需根据实际需求,调整配制量。
(2)推荐染毒培养体系配制方案(以 4 个受试物剂量组为例)
处理方式 | 组别 | 染毒用细胞液体积(mL) | 受试物体积(mL) | 溶剂体积(mL) | 阳性对照体积(mL) | |
CP | MMS | |||||
活化 | 阳性对照 | 19.8 | / | / | 0.2 | / |
剂量 1 | 19.8 | 0.2 | / | / | / | |
剂量 2 | 19.8 | 0.2 | / | / | / | |
剂量 3 | 19.8 | 0.2 | / | / | / | |
剂量 4 | 19.8 | 0.2 | / | / | / | |
溶剂对照 | 19.8 | / | 0.2 | / | / | |
不活化 | 阳性对照 | 19.8 | / | / | / | 0.2 |
剂量 1 | 19.8 | 0.2 | / | / | / | |
剂量 2 | 19.8 | 0.2 | / | / | / | |
剂量 3 | 19.8 | 0.2 | / | / | / | |
剂量 4 | 19.8 | 0.2 | / | / | / | |
溶剂对照 | 19.8 | / | 0.2 | / | / |
注:染毒时间可根据实际情况进行调整,一般为 3 h~6 h,必要时可延长到 1 个或多个细胞周期。若需进行 24 小时染毒,所用阳性底物需稀释 3 倍后再加入。
4、表达培养
染毒细胞经离心洗涤后,重悬细于 RPMI-10 培养液中,于在细胞培养瓶中表达培养 2 d。每天测定细胞密度,计算悬浮生长(SG)、相对悬浮生长(RSG)和细胞相对总生长(RTG),具体方法可参照国标方法要求。
5、突变频率测定
表达培养 2 天后,用含 20% 马血清、0.2 mg/mL 丙酮酸钠的 RPMI 1640 培养液(RPMI-20)重悬细胞,调整细胞密度为 1×104 个/mL,加入 TFT(终浓度 3 μg/mL),混匀,0.2 mL/孔接种 96 孔板(即 2000 个细胞/孔),于 37 ℃、5% 二氧化碳的培养箱中培养 12 d,10 μL/孔加入 MTT 染色剂,继续于培养箱中放置 2~4 h,计数每块平板有大集落 LC 和小集落 SC 生长的孔数。试验样品处理组和阳性对照组每份培养物各设 2 个重复;阴性溶媒对照组设 4 个重复。
6、数据处理和结果评价
数据处理方法和结果判定可参照:476 体外哺乳动物细胞基因突变试验,化学品测试方法健康效应卷(第二版),中国环境出版社,2013 年(ISBN:978-7-5111-1476-1);OECD 490 等。
注:在染毒处理和表达培养结束后,均需对平板接种效率进行测定,且要保证 PE 在 70%~130 之间,具体可参照国标方法进行。
【注意事项】
1. 实验前请自行准备 RPMI 1640 培养液、马血清、丙酮酸钠、细胞培养瓶、96 孔细胞培养板、灭菌枪头、无菌移液管、二氧化碳培养箱、振荡器、50 mL 离心管等,所有耗材需做无菌处理。
2. 实验操作应在符合细胞培养实验要求的环境下进行。
3. 细胞清除自发的突变使用的血清最好与正式试验血清同一厂家同一批号。
4. 实验过程中注意细胞计数的准确性。