蛋白互作常用的研究方法
北京百泰派克生物科技有限公司
蛋白互作技术
蛋白质是生物功能最直接的执行者,虽然一些蛋白质可以独立的完成他的使命,但是大部分的蛋白都是需要一些伴侣分子的协助一起完成任务或者形成复合物之后才能充分发挥他的功能。所以,了解蛋白质与蛋白质之间的相互作用,能够帮助我们更好的了解细胞的生命活性,揭示隐藏在表象下的调控机理。经典的蛋白互作分析研究方法主要包括三个:酵母双杂交、免疫共沉淀、GST-pull down。
1. 酵母双杂交技术:主要用来进行互作蛋白的筛选,缺点就是假阳性较高,所以需要进行结果验证,一般可采用免疫共沉淀或GST-pull down实验进行验证。
2. 免疫共沉淀:是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法。是确定两种蛋白质在完整细胞内相互作用的有效方法。当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。当用预先固化在argarose beads上的蛋白质A的抗体免疫沉淀A蛋白,那么与A蛋白在体内结合的蛋白质B也能一起沉淀下来。再通过蛋白变性分离,对B蛋白进行Western blot检测,进而证明两者间的相互作用。
3. GST pull-down实验:是一个行之有效的验证酵母双杂交系统的体外试验技术。其基本原理是先构建靶蛋白-GST融合蛋白载体,然后进行体外表达及纯化。将得到的靶蛋白-GST(Glutathione-S-transferase谷胱苷肽巯基转移酶)融合蛋白亲和固化在谷胱甘肽亲和树脂上,充当一种“诱饵蛋白”,然后将目的蛋白溶液过柱,可从中捕获与之相互作用的蛋白,将目的蛋白洗脱下来,通过SDS-PAGE电泳及western blot分析证实两种蛋白间的相互作用。
以上三种方法是比较经典的研究筛选和验证蛋白互作关系的方法。但是也存在一定局限性。酵母双杂交可以大规模的筛选未知的互作蛋白,但是假阳性高,免疫共沉淀及pull down只是对已知的蛋白互作关系进行验证,不能发现新的未知蛋白。
免疫沉淀-质谱联用IP-MS技术
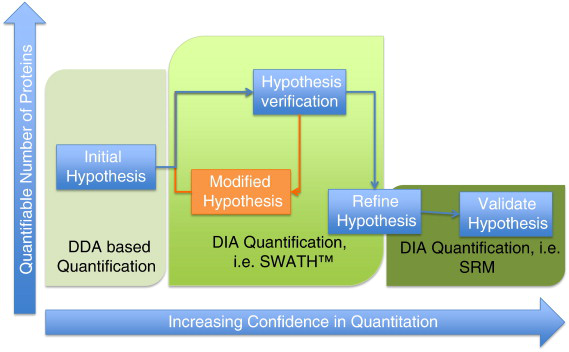
随着蛋白质组学技术的发展,将免疫亲和与质谱技术结合产生的IP-MS技术则逐渐显示出他的优势。原理是以细胞内源性靶蛋白为诱饵,将靶蛋白抗体与细胞总蛋白进行共孵育,促进免疫复合物的形成;随后加入能够与抗体结合的protein-A/G(预先结合固化在琼脂小珠上),形成”结合蛋白-靶蛋白-靶蛋白抗体-proteinA/G小珠”复合物,纯化该复合物凝胶电泳分离蛋白,应用质谱分析鉴定靶蛋白的结合蛋白。
免疫共沉淀与质谱结合,不仅能验证已知蛋白的相互作用,而且还可以鉴定与目标蛋白互作的未知蛋白,为科学研究提供全新的实验思路。北京百泰派克生物科技有限公司提供蛋白互作,GST pull down,免疫共沉淀及IP-MS相关服务,欢迎垂询!
资料来源:网络资料
图片来源:百泰派克生物【biotech-pack】


![十二烷基二甲基(3-磺丙基)氢氧化铵内盐 [用于生化研究],14933-08-5,≥98%,阿拉丁](https://img1.dxycdn.com/p/s14/2024/0619/475/6370229598169633081.jpg!wh200)